Ο Ευρωπαϊκός Οργανισμός Φαρμάκων (ΕΜΑ) συλλέγει δεδομένα σχετικά με τις ανεπιθύμητες ενέργειες των φαρμάκων στη βάση δεδομένων EudraVigilance. Αυτή περιλαμβάνει τα τέσσερα “εμβόλια” κατά της Covid που έχουν εγκριθεί στην ΕΕ. Οι υποθέσεις έχουν ήδη εκτοξευθεί μέσα στους πρώτους μήνες και είναι περισσότερες από ό,τι όλα τα προηγούμενα έτη μαζί. Ποτέ στο παρελθόν δεν υπήρξαν σκευάσματα με τόσο μαζικές παρενέργειες. Επιπλέον, υπάρχουν “ασυνήθιστες” αλλαγές και διαγραφές στη συγκεκριμένη βάση δεδομένων.
Η EudraVigilance διατηρεί επί του παρόντος 747.966 περιπτώσεις πρόκλησης τραυματισμών από εμβόλια για τα τέσσερα εμβόλια COVID-19 που έχουν λάβει άδεια κυκλοφορίας από τον EMA. Η ανάλυση των δεδομένων που είχαν ληφθεί προηγουμένως δείχνει ότι τουλάχιστον 83.928 περιπτώσεις έχουν διαγραφεί, πράγμα που σημαίνει ότι θα είχαν βρεθεί συνολικά 831.894 περιπτώσεις χωρίς τη διαγραφή.
Η μείωση του αριθμού των μεμονωμένων περιπτώσεων που εμφανίζονται σε μια διαδικτυακή αναφορά μπορεί να εξηγηθεί από τους ακόλουθους κύριους λόγους:
- λαμβάνεται αναφορά παρακολούθησης υφιστάμενης μεμονωμένης περίπτωσης στην οποία το αναφερόμενο φάρμακο, η δραστική ουσία ή η αναφερόμενη πιθανολογούμενη ανεπιθύμητη ενέργεια τροποποιείται από τον αναφέροντα λόγω νέων πληροφοριών
- μια αναφορά υποβάλλεται από περισσότερους του ενός αναφέροντες (π.χ. έναν ασθενή και έναν γιατρό)- κατά τη διάρκεια του ποιοτικού ελέγχου, αυτές οι διπλές αναφορές μπορούν να εντοπιστούν και να συνδυαστούν σε μια ενιαία αναφορά
- μια αναφορά ακυρώνεται (αφαιρείται) κατόπιν αιτήματος του αποστολέα, συνήθως επειδή η αναφορά είναι εσφαλμένη
Αυτή είναι η δήλωση του ΕΜΑ για το θέμα αυτό.
Βασικά, αυτό που λέγεται εδώ είναι ότι ο ΕΜΑ δεν πραγματοποιεί ελέγχους αξιοπιστίας. Η συγχώνευση των διπλότυπων εκθέσεων, που αναφέρεται ως ποιοτικός έλεγχος στο σημείο 2, είναι μια διαδικασία που μπορεί κανονικά να πραγματοποιηθεί ήδη κατά την εισαγωγή βάσει των προσωπικών δεδομένων. Μια μεταγενέστερη ανάλυση θα ήταν απαραίτητη μόνο για τις περιπτώσεις στις οποίες το πρόσωπο είχε δηλωθεί με δύο διαφορετικούς τρόπους, π.χ. ότι το δεύτερο μικρό όνομα είχε καταγραφεί στη μία έκθεση και έλειπε στην άλλη. Ένας μεγάλος αριθμός διαγραφών δεν είναι εύλογος εδώ.
Ο λόγος που αναφέρεται στο σημείο 1 ισοδυναμεί επίσης με διπλή αναφορά, αν και εδώ πρόκειται για τον ίδιο αναφέροντα και τα προσωπικά δεδομένα πρέπει να είναι πανομοιότυπα. Εδώ, ένας μεγάλος αριθμός διαγραφών είναι ακόμη λιγότερο αληθοφανής.
Ο λόγος που αναφέρεται στο σημείο 3 βασίζεται σε έναν ποιοτικό έλεγχο εκ μέρους του αποστολέα: Κατά τη στιγμή της αναφοράς, το σύμπτωμα φαινόταν να είναι παρενέργεια του εμβολιασμού- στη συνέχεια, βρέθηκε άλλη αιτία, γεγονός που καθιστά την ερμηνεία ως βλάβη από τον εμβολιασμό απίθανη. Αλλά κατά πόσο αυτό είναι πιθανό;
Σε κάθε περίπτωση, υπάρχει ένα ισχυρό ανασταλτικό όριο για την αναφορά ενός τραυματισμού από εμβολιασμό, επειδή τόσο ο γιατρός όσο και ο εμβολιαζόμενος έχουν θετικές προσδοκίες και, ως εκ τούτου, είναι πρόθυμοι να αποδεχτούν έναν ορισμένο βαθμό παρενεργειών. Ως εκ τούτου, η αναφορά γίνεται μόνο μετά από πραγματικά σοβαρά συμπτώματα ή αλλαγή στάσης σχετικά με τον εμβολιασμό. Το άτομο που κάνει την αναφορά θα πρέπει να είναι πολύ σίγουρο για το θέμα, ειδικά εφόσον πρόκειται μόνο για υποψία αντίδρασης εμβολιασμού. Συνεπώς, η απόσυρση μιας αναφοράς σημαίνει ότι η υποψία έχει εξαλειφθεί πλήρως. Αλλά πότε μπορεί να εξαλειφθεί εντελώς μια υποψία; Στην περίπτωση ενός νεκρού, η νεκροψία μπορεί να παράσχει βεβαιότητα- στην περίπτωση ενός ατόμου που είναι ακόμη εν ζωή, η δικαστική απόφαση επί αγωγής αποζημίωσης μπορεί να παράσχει βεβαιότητα. Και οι δύο περιπτώσεις είναι πολύ σπάνιες και δεν δικαιολογούν μεγαλύτερο αριθμό διαγραμμένων περιπτώσεων.
Αναλογιζόμενοι τη διατύπωση της αιτιολόγησης του ΕΜΑ, τίθεται το ερώτημα: τι γίνεται αν ο αποστολέας εδώ δεν εννοεί τον αρχικό γνωστοποιούντα, αλλά την εθνική αρχή ή τον κατασκευαστή;
Γνωρίζουμε ότι μια αναφορά περίπτωσης δεν πηγαίνει απευθείας στον ΕΜΑ. Στις περισσότερες περιπτώσεις, ο γιατρός ή ο πάσχων αναφέρει την ανεπιθύμητη ενέργεια στην εθνική αρχή, όπως ο Ε.Ο.Φ για την Ελλάδα. Στη συνέχεια, φυσικά, η ευθύνη της διαγραφής μεταβιβάζεται – και οι διαχειριστές δεδομένων της EudraVigilance νίπτουν τας χείρας τους.
Ο ΕΜΑ αφήνει ένα άλλο παραθυράκι ανοιχτό, κατονομάζοντας “κύριους λόγους”. Με άλλα λόγια, άλλοι δευτερεύοντες λόγοι είναι αποδεκτοί. Επομένως, είναι πολύ πιθανό να διαγράφονται περιπτώσεις για άλλους λόγους αληθοφάνειας. Ελλείψει περιοριστικών κριτηρίων, ο ΕΜΑ μπορεί επίσης να διαγράψει υποθέσεις για αφανείς λόγους και δεν δίνει καμία εξήγηση γι’ αυτό.
Επομένως, το 10,1% των διαγραμμένων αρχείων δεδομένων αποτελεί ήδη αιτία υποψίας; Στο πλαίσιο των λόγων που ανέφερε ο ΕΜΑ (διπλές αναφορές, εσφαλμένη αναφορά), ο αριθμός αυτός φαίνεται υψηλός, αλλά όχι αρκετά υψηλός ώστε να υποθέσουμε σκόπιμη χειραγώγηση του συνολικού αριθμού, διότι η ποιοτική ανάλυση ελάχιστα μεταβάλλεται από αυτό. Συνεπώς, αξίζει να αναλυθεί περαιτέρω κατά πόσον ορισμένες περιπτώσεις διαγράφονται κατά προτίμηση.
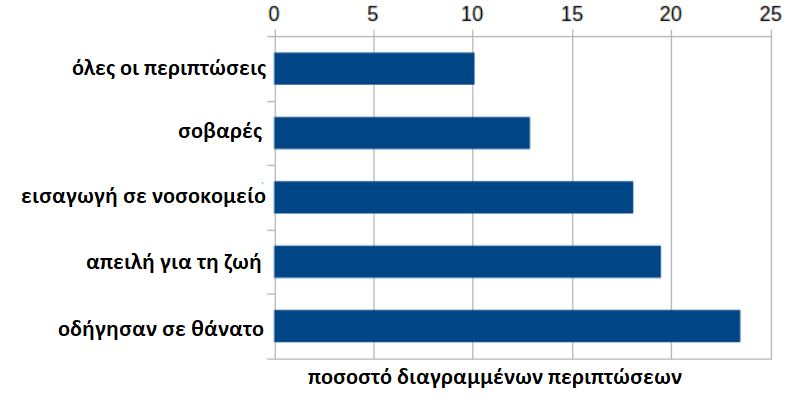
Είναι ενδιαφέρον ότι οι θάνατοι υπερτερούν σημαντικά στις διαγραφές σε ποσοστό 23,5%. Γιατί θα πρέπει να διαγράφονται δυσανάλογα συχνά ιδίως οι θάνατοι, δηλαδή να επηρεάζονται από διπλή αναφορά σύμφωνα με τον κατάλογο των λόγων του ΕΜΑ ή λόγω “εσφαλμένης αναφοράς”;
Σε απόλυτους αριθμούς: 11.892 θάνατοι είναι επί του παρόντος διαθέσιμοι, 3.653 θάνατοι διαγράφηκαν, ο συνολικός αριθμός των τρεχουσών και των διαγραμμένων περιπτώσεων είναι 15.545. Στην περίπτωση ενός θανάτου, το αποτέλεσμα της νεκροψίας θα πρέπει να ληφθεί υπόψη. Ωστόσο, οι διαγραφές υπερτερούν επίσης σημαντικά στις κατηγορίες “Απειλή για τη ζωή” (19,5%) και “Νοσηλεία σε νοσοκομείο” (18,1%).
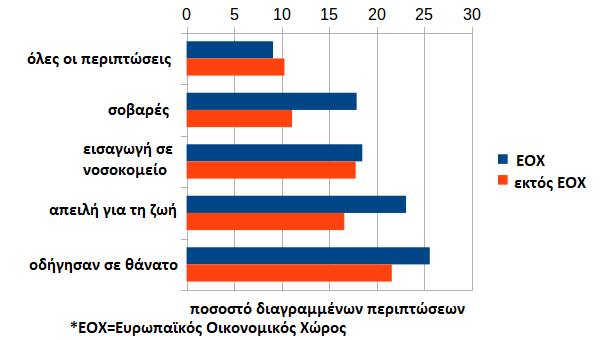
Γνωρίζουμε ότι τα δεδομένα της EudraVigilance προέρχονται από τις εθνικές αρχές και τους κατασκευαστές. Ωστόσο, καθώς πρόκειται μόνο για εθνικές αρχές της ΕΕ, όλες οι περιπτώσεις εκτός ΕΕ πρέπει να υποβάλλονται από τους κατασκευαστές, ενώ οι περιπτώσεις εντός ΕΕ προκύπτουν από τη συγχώνευση των εθνικών δεδομένων με τα δεδομένα του κατασκευαστή. Ως εκ τούτου, αξίζει να γίνει σύγκριση με βάση αν τα δεδομένα προέρχονται απο χώρα της ΕΕ, καθώς δίνει μια εικόνα της συμπεριφοράς των κατασκευαστών όσον αφορά τη διαγραφή.
Το ποσοστό ακύρωσης των κοινοποιήσεων είναι παρόμοιο εντός και εκτός της ΕΕ. Εκτός ΕΕ, οι θάνατοι, οι απειλητικές για τη ζωή καταστάσεις και οι νοσηλείες διαγράφονται επίσης κατά προτίμηση. Η μέση συμπεριφορά διαγραφής των κατασκευαστών δεν φαίνεται να διαφέρει πολύ από εκείνη των αρχών.
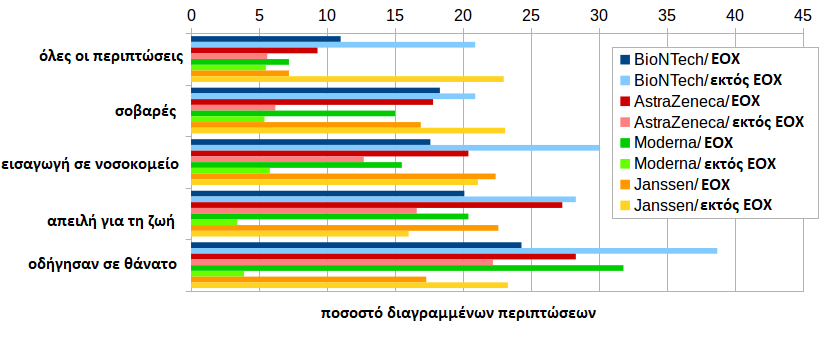
Από την άλλη πλευρά, κατά τη σύγκριση των κατασκευαστών, παρατηρούνται πολύ μεγάλες διαφορές. Για την BioNTech, το ποσοστό διαγραφής των θανάτων εκτός ΕΕ είναι 38,7%. Για την AstraZeneca και την Janssen είναι χαμηλότερα (22,3% και 23,3% αντίστοιχα), ενώ η Moderna διαγράφει πολύ λίγους θανάτους (3,9%). Εντός της ΕΕ, η σειρά είναι εντελώς διαφορετική: για τη Moderna το υψηλότερο ποσοστό διαγραφής είναι 31,8%, για την AstraZeneca 28,3%, για την BioNTech 24,3% και για την Janssen 17,3%. Γνωρίζοντας ότι οι υποθέσεις της ΕΕ αποτελούν ένα μείγμα αναφορών του κατασκευαστή και των αρχών, μπορεί να εξαχθεί το συμπέρασμα ότι οι εθνικές αρχές διαγράφουν κατά προτίμηση τους θανάτους της Moderna και της AstraZeneca.
Το ποσοστό διαγραφών της BioNTech εκτός ΕΕ είναι επίσης πάνω από το μέσο όρο στις άλλες κατηγορίες (όλες οι περιπτώσεις, σοβαρές, απειλητικές για τη ζωή, που προκαλούν νοσηλεία).
Μια εκτεταμένη ανάλυση βασίζεται στην ομαδοποίηση των αναφερόμενων αντιδράσεων σε συμπλέγματα συμπτωμάτων. Το ερώτημα είναι αν ορισμένες παρενέργειες διαγράφονται κατά προτίμηση.
Οι περιπτώσεις COVID-19 διαγράφονται συχνότερα με ποσοστό 27,2%.
Αυτό εγείρει φυσικά το ερώτημα της ερμηνείας μιας νόσου COVID-19 μετά τον εμβολιασμό. Μπορεί να υποστηριχθεί ότι η πραγματική αιτία της νόσου ήταν μια λοίμωξη SARS-CoV2 και ότι απουσίαζε μόνο η ανοσοποιητική δράση του εμβολιασμού. Όμως αυτή η ερμηνεία είναι προβληματική ως γενική εξήγηση, διότι για την ερμηνεία αυτή θα πρέπει να αποδειχθεί ότι υπήρξε πράγματι μετάδοση ιών.
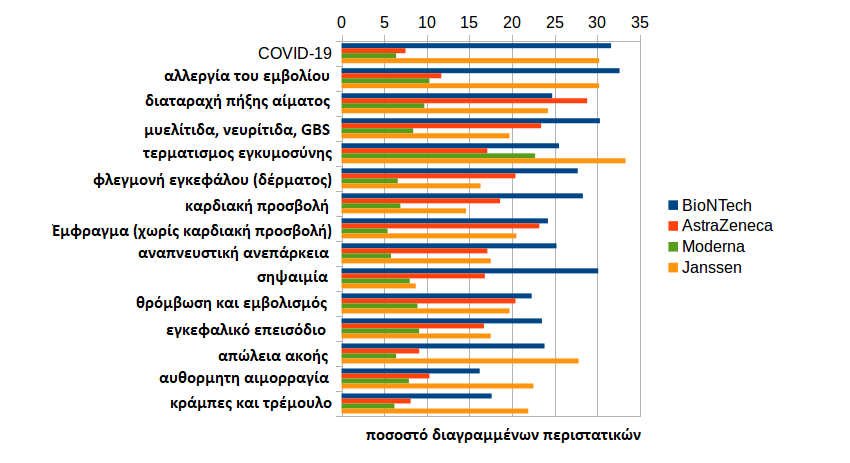
Η αλλεργία στα εμβόλια (26,7%), η διαταραχή της πήξης του αίματος (26,0%), η μυελίτιδα (23,6%), η διακοπή της εγκυμοσύνης (23,1%) και η καρδιακή προσβολή (21,0%) διαγράφονται ιδιαίτερα συχνά στο σύμπλεγμα συμπτωμάτων. Και εδώ υπάρχουν μεγάλες διαφορές μεταξύ των εμβολίων.
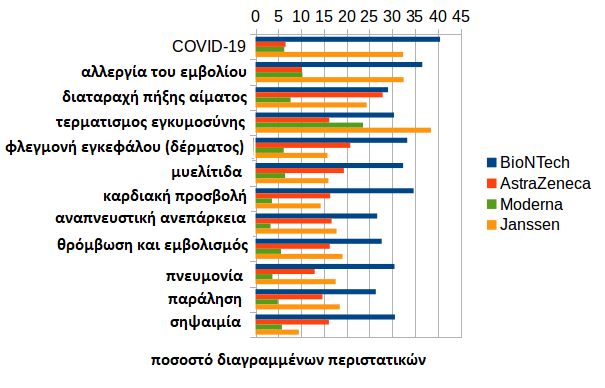
Η διαγραφή των περιπτώσεων εντός της ΕΕ δεν διαφέρει τόσο πολύ μεταξύ των εμβολίων, οπότε οι εθνικές αρχές πιθανώς δύσκολα διαφοροποιούνται μεταξύ των κατασκευαστών όσον αφορά τη συμπεριφορά τους στη διαγραφή. Εκτός της ΕΕ, όπου οι διαγραφές φαίνεται να λαμβάνονται από τους κατασκευαστές, υπάρχουν έντονες διαφορές.
Στην πραγματικότητα, η βάση των δεδομένων των κατασκευαστών είναι διαφορετική από εκείνη των εθνικών αρχών. Ενώ οι εθνικές αρχές έχουν τη βασική υποχρέωση να αποθηκεύουν όλα τα ύποπτα περιστατικά, οι ύποπτες περιπτώσεις των κατασκευαστών αποτελούν ουσιαστικά εσωτερικές βάσεις δεδομένων. Εξυπηρετούν κυρίως το σκοπό ενός μεταγενέστερου ελέγχου του προϊόντος και, εάν ο κατασκευαστής θεωρεί ότι ορισμένες παρενέργειες δεν είναι σχετικές, δεν υπάρχει κανένας λόγος να μην τις διαγράψει από τη βάση δεδομένων. Έτσι, μπορούμε να συμπεράνουμε από τις διαγραφές ότι:
-BioNTech:Αιφνίδιος θάνατος (45,6%), COVID-19 (40,5%), αλλεργίες (36,6%), καρδιακή προσβολή (34,7%), φλεγμονή εγκεφάλου (δέρματος) (33,3%)
-AstraZeneca: Διαταραχές πήξης του αίματος (27,7%)
-Moderna: Διακοπές εγκυμοσύνης (23,6%)
-Janssen: Διακοπή εγκυμοσύνης (38,5%), νεφρική βλάβη (39,2%), απώλεια ακοής (34,6%), αλλεργίες (32,5%), COVID-19 (32,4%), κράμπες και ρίγη (29,6%), αυθόρμητη αιμορραγία (29,4%)
θεωρούνται λιγότερο συναφή και προτιμούν να τα διαγράψουν.
Συμπέρασμα
Εάν οι διαγραφές γίνονταν μόνο λόγω διπλής αναφοράς και τυπικών σφαλμάτων, τότε θα έπρεπε να είναι ομοιόμορφα κατανεμημένες σε όλα τα εμβόλια, τις σοβαρότητες και τις κατηγορίες συμπτωμάτων. Ωστόσο, αυτό δεν ισχύει καθόλου- τα ποσοστά κυμαίνονται από 5% έως πάνω από 40%, και είναι ακριβώς οι θάνατοι και οι ιδιαίτερα σοβαρές κλινικές εικόνες που διαγράφονται δυσανάλογα. Εδώ υπάρχει σαφής προκατάληψη όσον αφορά τη σοβαρότητα, η οποία επίσης διαφέρει σημαντικά μεταξύ των κατασκευαστών και της ταξινόμησης της ΕΕ.
Η εικόνα που προκύπτει είναι ότι οι ήπιες περιπτώσεις παραμένουν στη βάση δεδομένων, αλλά οι σοβαρές παρενέργειες διαγράφονται σε σημαντικό βαθμό.
Το αν υπάρχει μια αρχική υποψία χειραγωγικής πρόθεσης πίσω από αυτό είναι θέμα που θα κρίνουν άλλοι. Σε κάθε περίπτωση, οι εμπλεκόμενοι οργανισμοί και εταιρείες πρέπει να απαντήσουν σε αρκετά κρίσιμα ερωτήματα.
Μεθοδολογία
Δεδομένα που λήφθηκαν από το LineListingReport of EudraVigilance (https://www.adrreports.eu/) σε διαφορετικές χρονικές στιγμές, εξήχθησαν και συνοψίστηκαν σύμφωνα με κατηγορίες σοβαρότητας (που δίνονται στις αντιδράσεις) και συμπλέγματα συμπτωμάτων (που δημιουργήθηκαν από ομάδα αναλυτών).
Μια υπόθεση αναφέρεται πάντα σε έναν κωδικό ΕΕ-ΕΚ, δηλαδή σε ένα φυσικό πρόσωπο για το οποίο γίνεται αναφορά.
Τα ποσοστά που δίνονται αφορούν την αναλογία των διαγραμμένων υποθέσεων προς το άθροισμα των τρεχουσών και των διαγραμμένων υποθέσεων.
Η ημερομηνία των δεδομένων είναι μέχρι τις 24.7.2021
Follow us: