Οι ασθενείς και οι γιατροί αναμένουν από τις ρυθμιστικές αρχές φαρμάκων να παρέχουν αμερόληπτη, αυστηρή αξιολόγηση των ερευνητικών φαρμάκων πριν αυτά κυκλοφορήσουν στην αγορά. Διαθέτουν όμως επαρκή ανεξαρτησία από τις εταιρείες τις οποίες οφείλουν να ρυθμίζουν; Η Maryanne Demasi ερευνά για το BMJ.
Τις τελευταίες δεκαετίες, οι ρυθμιστικές υπηρεσίες είδαν μεγάλα ποσοστά του προϋπολογισμού τους να χρηματοδοτούνται από τη βιομηχανία που έχουν αναλάβει να ρυθμίζουν.
Το 1992, το Κογκρέσο των ΗΠΑ ψήφισε τον νόμο περί τελών χρήσης συνταγογραφούμενων φαρμάκων (PDUFA), επιτρέποντας στη βιομηχανία να χρηματοδοτεί απευθείας τον Οργανισμό Τροφίμων και Φαρμάκων των ΗΠΑ (FDA) μέσω “τελών χρήσης” που αποσκοπούσαν στην υποστήριξη του κόστους της ταχείας εξέτασης των αιτήσεων για φάρμακα. Με την πράξη αυτή, ο FDA μετατράπηκε από μια πλήρως χρηματοδοτούμενη από τους φορολογούμενους οντότητα σε μια οντότητα που συμπληρώνεται από χρήματα της βιομηχανίας. Τα καθαρά τέλη PDUFA που εισπράχθηκαν αυξήθηκαν κατά 30 φορές – από περίπου 29 εκατ. δολάρια το 1993 σε 884 εκατ. δολάρια το 2016.
Στην Ευρώπη, τα τέλη της βιομηχανίας χρηματοδότησαν το 20% της νέας ρυθμιστικής αρχής της ΕΕ, του Ευρωπαϊκού Οργανισμού Φαρμάκων (ΕΜΑ), το 1995. Μέχρι το 2010 το ποσοστό αυτό είχε ανέλθει στο 75%- σήμερα είναι 89%.
Το 2005 στο Ηνωμένο Βασίλειο, η επιτροπή υγείας της Βουλής των Κοινοτήτων αξιολόγησε την επιρροή της φαρμακοβιομηχανίας στην πολιτική υγείας, συμπεριλαμβανομένου του Οργανισμού Ρύθμισης Φαρμάκων και Προϊόντων Υγείας (MHRA). Η επιτροπή ανησυχούσε ότι η χρηματοδότηση της βιομηχανίας θα μπορούσε να οδηγήσει τον οργανισμό στο να “χάσει από τα μάτια του την ανάγκη να προστατεύει και να προάγει τη δημόσια υγεία πάνω απ’ όλα, καθώς επιδιώκει να κερδίσει έσοδα από αμοιβές από τις εταιρείες”. Αλλά σχεδόν δύο δεκαετίες μετά, λίγα έχουν αλλάξει και η χρηματοδότηση των ρυθμιστικών αρχών φαρμάκων από τη βιομηχανία έχει γίνει ο διεθνής κανόνας.
Το BMJ υπέβαλε σε έξι κορυφαίες ρυθμιστικές αρχές, στην Αυστραλία, τον Καναδά, την Ευρώπη, την Ιαπωνία, το Ηνωμένο Βασίλειο και τις ΗΠΑ, μια σειρά ερωτήσεων σχετικά με τη χρηματοδότησή τους, τη διαφάνεια στη λήψη αποφάσεων (και των δεδομένων) και τον ρυθμό με τον οποίο εγκρίνονται τα νέα φάρμακα. Διαπιστώσαμε ότι τα χρήματα της βιομηχανίας διαχέονται στις κορυφαίες ρυθμιστικές αρχές του πλανήτη, εγείροντας ερωτήματα σχετικά με την ανεξαρτησία τους, ιδίως μετά από μια σειρά σκανδάλων φαρμάκων και συσκευών.
Τέλη βιομηχανίας
Το χρήμα της βιομηχανίας κατακλύζει τις κορυφαίες ρυθμιστικές αρχές του πλανήτη. Το BMJ διαπίστωσε ότι η πλειονότητα του προϋπολογισμού των ρυθμιστικών αρχών -ιδιαίτερα το τμήμα που επικεντρώνεται στα φάρμακα- προέρχεται από τις αμοιβές της βιομηχανίας.
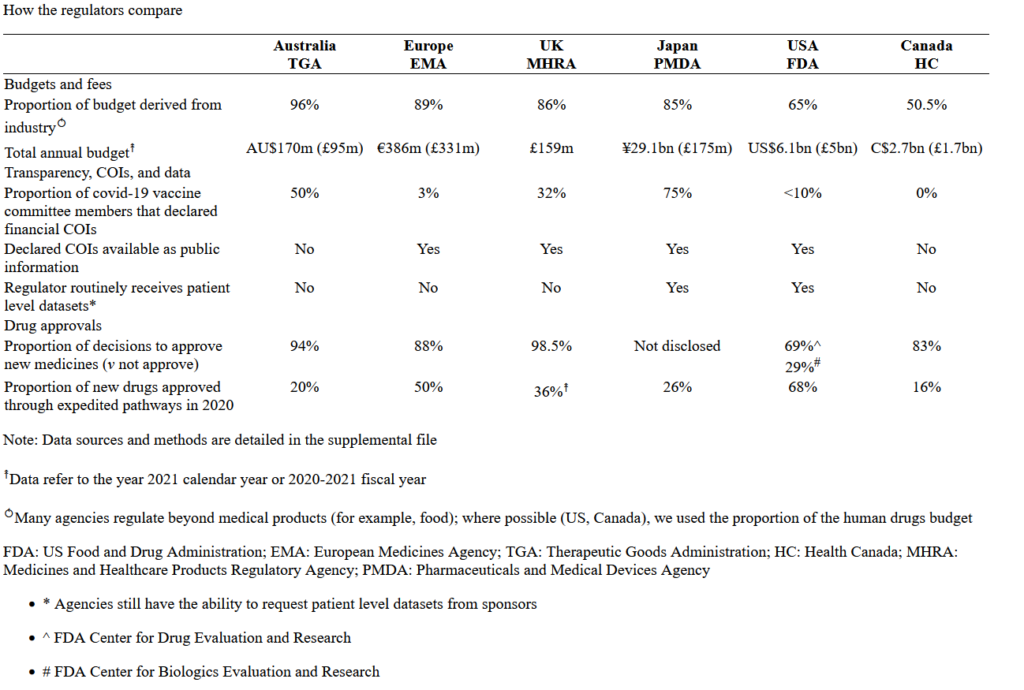
Από τις έξι ρυθμιστικές αρχές, η Αυστραλία είχε το υψηλότερο ποσοστό του προϋπολογισμού από τα τέλη της βιομηχανίας (96%) και την περίοδο 2020-2021 ενέκρινε περισσότερες από εννέα από κάθε δέκα αιτήσεις φαρμακευτικών εταιρειών. Η Διοίκηση Θεραπευτικών Προϊόντων (TGA) της Αυστραλίας αρνείται σθεναρά ότι η σχεδόν αποκλειστική εξάρτησή της από τη χρηματοδότηση της φαρμακοβιομηχανίας αποτελεί σύγκρουση συμφερόντων (COI). Απαντώντας σε σχετικό ερώτημα, ο οργανισμός δήλωσε: “Όλα τα τέλη και οι επιβαρύνσεις προβλέπονται από τη νομοθεσία μας. Για λόγους διαφάνειας, τα τέλη και οι χρεώσεις της TGA δημοσιεύονται στον δικτυακό τόπο της TGA”.
Όμως εδώ και δεκαετίες οι ακαδημαϊκοί θέτουν ερωτήματα σχετικά με την επιρροή που έχει η χρηματοδότηση στις ρυθμιστικές αποφάσεις, ιδίως μετά από μια σειρά σκανδάλων φαρμάκων και συσκευών – συμπεριλαμβανομένων των οπιοειδών, των φαρμάκων για τη νόσο Αλτσχάιμερ, των αντιικών της γρίπης, των πυελικών πλεγμάτων, των αρθρικών προθέσεων, των εμφυτευμάτων μαστού και αντισυλληπτικών, των καρδιακών στεντ και των βηματοδοτών. Μια ανάλυση των τριών δεκαετιών PDUFA στις ΗΠΑ έδειξε πώς η εξάρτηση από τις αμοιβές της βιομηχανίας συμβάλλει στη μείωση των αποδεικτικών προτύπων, βλάπτοντας τελικά τους ασθενείς. Στην Αυστραλία, οι εμπειρογνώμονες ζήτησαν πλήρη αναθεώρηση της δομής και της λειτουργίας της TGA, υποστηρίζοντας ότι ο οργανισμός έχει έρθει πολύ κοντά στη βιομηχανία.
Ο κοινωνιολόγος Donald Light του Πανεπιστημίου Rowan στο Νιου Τζέρσεϊ των ΗΠΑ, ο οποίος έχει περάσει δεκαετίες μελετώντας τη ρύθμιση των φαρμάκων, λέει: “Όπως και ο FDA, η TGA ιδρύθηκε για να είναι ένα ανεξάρτητο ινστιτούτο. Ωστόσο, το γεγονός ότι χρηματοδοτείται σε μεγάλο βαθμό από τα τέλη των εταιρειών, τα προϊόντα των οποίων καλείται να αξιολογήσει, αποτελεί θεμελιώδη σύγκρουση συμφερόντων και χαρακτηριστικό παράδειγμα θεσμικής διαφθοράς“.
Ο Light λέει ότι το πρόβλημα με τις ρυθμιστικές αρχές φαρμάκων είναι ευρέως διαδεδομένο. Ακόμη και ο FDA -η πιο καλά χρηματοδοτούμενη ρυθμιστική αρχή- αναφέρει ότι το 65% της χρηματοδότησής του για την αξιολόγηση των φαρμάκων προέρχεται από τέλη χρήσης της βιομηχανίας και με την πάροδο των ετών τα τέλη χρήσης έχουν επεκταθεί στα γενόσημα φάρμακα, τα βιοομοειδή και τις ιατρικές συσκευές.
Είναι το αντίθετο από το να έχουμε έναν αξιόπιστο οργανισμό που αξιολογεί ανεξάρτητα και αυστηρά τα φάρμακα. Δεν είναι αυστηροί, δεν είναι ανεξάρτητοι, είναι επιλεκτικοί και αποκρύπτουν δεδομένα. Οι γιατροί και οι ασθενείς πρέπει να εκτιμήσουν πόσο βαθιά και εκτεταμένα δεν μπορούν να εμπιστευτούν τις ρυθμιστικές αρχές φαρμάκων όσο είναι δέσμιες της χρηματοδότησης της βιομηχανίας.
Εξωτερικοί σύμβουλοι
Η ανησυχία σχετικά με την COI δεν αφορά μόνο όσους εργάζονται για τις ρυθμιστικές αρχές, αλλά επεκτείνεται και στις συμβουλευτικές επιτροπές που προορίζονται να παρέχουν στις ρυθμιστικές αρχές ανεξάρτητες συμβουλές εμπειρογνωμόνων. Μια έρευνα του BMJ πέρυσι διαπίστωσε ότι αρκετοί ειδικοί σύμβουλοι για τις συμβουλευτικές επιτροπές εμβολίων covid-19 στο Ηνωμένο Βασίλειο και τις ΗΠΑ είχαν οικονομικούς δεσμούς με κατασκευαστές εμβολίων – δεσμούς που οι ρυθμιστικές αρχές έκριναν ως αποδεκτούς. Μια μεγάλη μελέτη που διερεύνησε τον αντίκτυπο των COIs μεταξύ των μελών των συμβουλευτικών επιτροπών του FDA επί 15 χρόνια διαπίστωσε ότι τα άτομα με οικονομικά συμφέροντα αποκλειστικά στην εταιρεία-χορηγό είχαν περισσότερες πιθανότητες να ψηφίσουν υπέρ του προϊόντος του χορηγού, και ότι τα άτομα που υπηρέτησαν σε συμβουλευτικές επιτροπές αποκλειστικά για τον χορηγό είχαν σημαντικά περισσότερες πιθανότητες να ψηφίσουν υπέρ του προϊόντος του χορηγού. Ωστόσο, δεν υπάρχουν έρευνες που να διερευνούν το θέμα από μια διακρατική συγκριτική προοπτική.
Στην Αυστραλία, η σύνθεση της συμβουλευτικής επιτροπής για τα εμβόλια της TGA δημοσιεύεται στον δικτυακό τόπο του οργανισμού. Ωστόσο, τα έντυπα για την καταγραφή των προηγούμενων και τρεχόντων οικονομικών και μη οικονομικών συμφερόντων δεν δημοσιοποιούνται. Σε αίτημα του νόμου περί ελευθερίας των πληροφοριών (FOI Act) για τις οικονομικές δημοσιοποιήσεις τους τον Αύγουστο του 2020, τα ονόματα και οι λεπτομέρειες των δημοσιοποιήσεων είχαν διαγραφεί. Μετά από αναζήτηση πρόσθετων λεπτομερειών, η TGA ανέφερε ότι πρόκειται για “προσωπικές πληροφορίες” και επομένως συνήθως εξαιρούνται σύμφωνα με τον νόμο FOI. Στη συνέχεια, τα μέλη της επιτροπής προσεγγίστηκαν απευθείας μέσω ηλεκτρονικού ταχυδρομείου και ρωτήθηκαν αν θα ήταν πρόθυμα να δημοσιεύσουν τις δηλώσεις τους, αλλά δεν υπήρξε καμία απάντηση. Αντ’ αυτού, παρέπεμψαν το ερώτημα πίσω στην TGA, η οποία ήταν πρόθυμη να αποκαλύψει ότι 5 από τα 10 μέλη της επιτροπής γνωστοποίησαν COI -αλλά δεν είπε ποια μέλη ή δεν παρείχε λεπτομέρειες, προσθέτοντας ότι “τα συμφέροντα αυτά συνήθως δεν δημιουργούν σύγκρουση”. Η πολιτική του οργανισμού επιτρέπει τον αποκλεισμό των μελών από ορισμένες συνεδριάσεις λόγω ενός COI, αλλά οι λεπτομέρειες του COI και οι λόγοι του αποκλεισμού δεν δημοσιεύονται.
Ο Joel Lexchin, ερευνητής της πολιτικής για τα φάρμακα στο Πανεπιστήμιο York στο Τορόντο, λέει: “Οι άνθρωποι πρέπει να γνωρίζουν για τυχόν οικονομικές COI που έχουν όσοι δίνουν συμβουλές, ώστε να μπορούν να αξιολογήσουν κατά πόσον οι εν λόγω COI έχουν επηρεάσει τις συμβουλές που λαμβάνουν. Οι άνθρωποι πρέπει να είναι σε θέση να εμπιστεύονται αυτά που ακούνε από αξιωματούχους της δημόσιας υγείας και η έλλειψη διαφάνειας διαβρώνει την εμπιστοσύνη“.
Από τις έξι μεγάλες ρυθμιστικές αρχές στις οποίες απευθύνθηκε το The BMJ, μόνο οι ρυθμιστικές αρχές φαρμάκων του Καναδά δεν ζητούσαν συστηματικά συμβουλές από ανεξάρτητη επιτροπή και η ομάδα αξιολόγησής της ήταν η μόνη που ήταν εντελώς απαλλαγμένη από οικονομικά COIs. Οι ρυθμιστικές αρχές της Ευρώπης, της Ιαπωνίας και του Ηνωμένου Βασιλείου δημοσιεύουν κατάλογο των μελών με τις πλήρεις δηλώσεις τους στο διαδίκτυο για δημόσια πρόσβαση, ενώ ο FDA κρίνει τα COIs ανά συνεδρίαση και μπορεί να χορηγεί απαλλαγές που επιτρέπουν τη συμμετοχή των μελών.
Διαφάνεια, σύγκρουση συμφερόντων(COI) και δεδομένα
Κατά την τελευταία δεκαετία, υπήρξε βελτίωση της διαφάνειας και της προσβασιμότητας των δεδομένων των δοκιμών. Σήμερα, τόσο ο EMA όσο και ο Health Canada (HC) δημοσιεύουν στον ιστότοπό τους σημαντικές ποσότητες κλινικών δεδομένων που έχουν παραληφθεί από τον χορηγό φαρμάκου. Επιπλέον, ο Οργανισμός Φαρμακευτικών Προϊόντων και Ιατρικών Συσκευών (PMDA) της Ιαπωνίας δημοσιεύει περιλήψεις μη κλινικών δεδομένων.
Οι περισσότεροι ρυθμιστικοί οργανισμοί δεν προβαίνουν, ωστόσο, σε δική τους αξιολόγηση των ατομικών δεδομένων των ασθενών, αλλά βασίζονται σε περιλήψεις που ετοιμάζει ο χορηγός του φαρμάκου. Η TGA, για παράδειγμα, αναφέρει ότι διενεργεί τις αξιολογήσεις του εμβολίου covid-19 με βάση “τις πληροφορίες που παρέχει ο κατασκευαστής του εμβολίου“. Σύμφωνα με ένα αίτημα FOI του περασμένου Μαΐου, η TGA δήλωσε ότι δεν είχε δει τα αρχικά δεδομένα από τις δοκιμές του εμβολίου covid-19. Αντίθετα, ο οργανισμός αξιολόγησε τα “συγκεντρωτικά ή ομαδοποιημένα δεδομένα” του κατασκευαστή. Η TGA δεν διαθέτει τα σύνολα δεδομένων σε επίπεδο μεμονωμένων συμμετεχόντων που αφορούν τις δοκιμές του εμβολίου covid-19, τα οποία κατέχει ο κατασκευαστής του εμβολίου.
“Η TGA δεν θα έπρεπε να βασίζεται στην ανάλυση των εν λόγω δεδομένων που παρήγαγαν οι φαρμακευτικές εταιρείες. Αντίθετα, η TGA θα πρέπει να αναλύσει εκ νέου τα δεδομένα της πηγής”, λέει ο Lexchin. “Περαιτέρω, η TGA θα πρέπει να διοργανώνει δημόσιες ακροάσεις πριν από την έγκριση νέων φαρμάκων, ώστε να μπορεί να ακούσει τα μέλη του κοινού και εξωτερικούς επιστήμονες“.
Η TGA δεν είναι μόνη της. Μεταξύ των παγκόσμιων ρυθμιστικών αρχών, μόνο δύο – ο FDA και ο PMDA – λαμβάνουν συστηματικά σύνολα δεδομένων σε επίπεδο ασθενούς. Και κανένας από τους δύο δεν δημοσιεύει προληπτικά αυτά τα δεδομένα. Πρόσφατα, μια ομάδα περισσότερων από 80 καθηγητών και ερευνητών που ονομάζεται Public Health and Medical Professionals for Transparency (Δημόσια Υγεία και Ιατρικοί Επαγγελματίες για τη Διαφάνεια) μήνυσε τον FDA για πρόσβαση σε όλα τα δεδομένα που χρησιμοποίησε ο οργανισμός για να χορηγήσει άδεια για το εμβόλιο covid-19 της Pfizer.19 Ο FDA υποστήριξε ότι η επιβάρυνση του οργανισμού ήταν πολύ μεγάλη και ζήτησε να του επιτραπεί να δημοσιεύει κατάλληλα επεξεργασμένα έγγραφα με ρυθμό 500 σελίδων το μήνα, μια ταχύτητα που θα χρειαζόταν περίπου 75 χρόνια για να ολοκληρωθεί. Σε μια νίκη για τους υποστηρικτές της διαφάνειας, αυτό ανατράπηκε από δικαστή του ομοσπονδιακού δικαστηρίου των ΗΠΑ, ο οποίος αποφάσισε ότι ο FDA θα έπρεπε να παραδώσει όλα τα κατάλληλα επεξεργασμένα δεδομένα εντός οκτώ μηνών. Η Pfizer ζήτησε να παρέμβει για να διασφαλίσει ότι “οι πληροφορίες που εξαιρούνται από την κοινοποίηση σύμφωνα με τον νόμο FOI δεν αποκαλύπτονται ακατάλληλα”, αλλά το αίτημά της απορρίφθηκε.
Ταχείες εγκρίσεις
Μετά την κρίση του AIDS στις δεκαετίες του 1980 και 1990, εισήχθησαν στις ΗΠΑ “τέλη χρήσης” PDUFA για τη χρηματοδότηση πρόσθετου προσωπικού που θα συνέβαλε στην επιτάχυνση της έγκρισης νέων θεραπειών. Έκτοτε, υπήρξε ανησυχία για τον τρόπο με τον οποίο διαμόρφωσε τη διαδικασία κανονιστικής εξέτασης – για παράδειγμα, με τη δημιουργία “ημερομηνιών PDUFA”, προθεσμιών για την εξέταση των αιτήσεων από τον FDA και πλήθος “ταχέων διαδικασιών” για την επιτάχυνση της κυκλοφορίας των φαρμάκων στην αγορά. Η πρακτική αυτή αποτελεί πλέον παγκόσμιο κανόνα.
Σήμερα, όλες οι μεγάλες ρυθμιστικές αρχές προσφέρουν ταχείες διαδικασίες που χρησιμοποιούνται σε σημαντικό ποσοστό των εγκρίσεων νέων φαρμάκων. Το 2020, το 68% των εγκρίσεων φαρμάκων στις ΗΠΑ έγινε μέσω ταχείας διαδικασίας, το 50% στην Ευρώπη και το 36% στο Ηνωμένο Βασίλειο.
Οι διαδικασίες ταχείας έγκρισης οδήγησαν σε νέα φάρμακα που ήταν πιο πιθανό να αποσυρθούν για λόγους ασφαλείας, πιο πιθανό να φέρουν επακόλουθη προειδοποίηση και πιο πιθανό να έχουν μία ή περισσότερες δοσολογικές μορφές που διακόπηκαν οικειοθελώς από τον παρασκευαστή.
“Ένας λόγος για τον οποίο τα φάρμακα που εγκρίθηκαν από τον FDA τόσο κοντά στην καταληκτική ημερομηνία μπορεί να είχαν περισσότερα προβλήματα ασφάλειας είναι ότι οι ελεγκτές του FDA φοβόντουσαν μήπως υπερβούν την προθεσμία για τη λήψη απόφασης και θέσουν έτσι σε κίνδυνο τα έσοδα που λαμβάνει ο FDA από τις φαρμακευτικές εταιρείες“, λέει ο Lexchin.
Ο Aaron Kesselheim, καθηγητής ιατρικής στο Νοσοκομείο Brigham and Women’s και στην Ιατρική Σχολή του Χάρβαρντ, προσθέτει ότι οι επιταχυνόμενες εγκρίσεις έχουν γενικά χαμηλότερο βάρος απόδειξης της αποτελεσματικότητας.
“Η οδός ταχείας έγκρισης αλλάζει ρητά το υποκείμενο “πρότυπο” αποτελεσματικότητας, καθώς επιτρέπει την έγκριση με βάση αλλαγές σε ένα υποκατάστατο μέτρο που δεν είναι καλά επικυρωμένο και είναι μόνο εύλογα πιθανό να προβλέπει το κλινικό όφελος”, λέει ο Kesselheim, ο οποίος παραιτήθηκε από μια συμβουλευτική επιτροπή του FDA πέρυσι σε ένδειξη διαμαρτυρίας για την έγκριση από τον οργανισμό ενός αμφιλεγόμενου φαρμάκου για τη νόσο Αλτσχάιμερ. Μετά την αρνητική ψήφο της επιτροπής κατά της έγκρισης, ο FDA άλλαξε τους στόχους, εγκρίνοντας το Aducanumab μέσω μιας επιταχυνόμενης έγκρισης με βάση το αμφισβητούμενο υποκατάστατο μέτρο της μείωσης των ορατών επιπέδων της πρωτεΐνης β-αμυλοειδούς.
Ο Courtney Davis, ιατρικός και πολιτικός κοινωνιολόγος στο Kings College του Λονδίνου, λέει ότι μια γενική φορολογία ή μια εισφορά των φαρμακευτικών εταιρειών θα ήταν καλύτερες επιλογές για τη χρηματοδότηση των ρυθμιστικών αρχών. “Η PDUFA είναι το χειρότερο είδος ρύθμισης, καθώς επιτρέπει στη βιομηχανία να διαμορφώνει τις πολιτικές και τις προτεραιότητες του FDA με πολύ άμεσο τρόπο. Κάθε φορά που επανεγκρίθηκε η PDUFA, η βιομηχανία είχε θέση στο τραπέζι για να επαναδιαπραγματευτεί τους όρους της χρηματοδότησής της και να καθορίσει με ποιες μετρήσεις απόδοσης και στόχους θα πρέπει να αξιολογείται ο οργανισμός. Εξ ου και η εστίαση του FDA στη λήψη όλο και ταχύτερων αποφάσεων έγκρισης – ακόμη και για φάρμακα που δεν κρίνονται ως θεραπευτικά σημαντικά για τους ασθενείς“.
Οι “περιστρεφόμενες πόρτες” ρυθμιστή-βιομηχανίας
Οι επικριτές υποστηρίζουν ότι η δέσμευση των ρυθμιστικών αρχών δεν οφείλεται μόνο στον τρόπο με τον οποίο χρηματοδοτούνται οι οργανισμοί, αλλά και στη στελέχωσή τους. Μια “περιστρεφόμενη πόρτα” που έχει δει πολλούς υπαλλήλους των οργανισμών να καταλήγουν να εργάζονται ή να παρέχουν συμβουλές για τις ίδιες εταιρείες που ρύθμιζαν.
Στον FDA, που θεωρείται γενικά ως η κορυφαία ρυθμιστική αρχή στον κόσμο, εννέα στους δέκα προηγούμενους επιτρόπους του μεταξύ 2006 και 2019 συνέχισαν να εξασφαλίζουν ρόλους που συνδέονται με φαρμακευτικές εταιρείες, ενώ ο 11ος και πιο πρόσφατος, ο Στίβεν Χαν, εργάζεται για την Flagship Pioneering, μια εταιρεία που λειτουργεί ως θερμοκοιτίδα για νέες βιοφαρμακευτικές εταιρείες.
Τον Φεβρουάριο, η αμερικανική Γερουσία ενέκρινε οριακά τον Robert Califf, καρδιολόγο, για να ηγηθεί του FDA, θέση την οποία κατείχε προηγουμένως υπό την κυβέρνηση Ομπάμα. Η επαναπρόσληψη του Califf οδήγησε ορισμένους γερουσιαστές να υποστηρίξουν ότι οι δεσμοί του με τη φαρμακοβιομηχανία τον καθιστούσαν ακατάλληλο για το ρόλο. Τα έντυπα δημοσιοποίησης οικονομικών στοιχείων δείχνουν ότι ο Califf πληρώθηκε με 2,7 εκατ. δολάρια από τη Verily Life Sciences και το 2021 κατείχε θέση στα διοικητικά συμβούλια δύο φαρμακευτικών εταιρειών, της AmyriAD και της Centessa Pharmaceuticals.
Αφού παραιτήθηκε από ανώτερη θέση στο τμήμα εμβολίων του FDA, ο Philip Krause εξασφάλισε ρόλο στον τομέα της βιοτεχνολογίας. Μια μελέτη διαπίστωσε ότι πάνω από το ένα τέταρτο των υπαλλήλων του FDA που ενέκριναν φάρμακα για τον καρκίνο και την αιματολογία μεταξύ 2001 και 2010 εγκατέλειψαν τον οργανισμό και τώρα εργάζονται ή συμβουλεύουν φαρμακευτικές εταιρείες.
Πέραν του FDA, ο Ian Hudson, διευθύνων σύμβουλος του MHRA του Ηνωμένου Βασιλείου μεταξύ 2013 και 2019, συμμετέχει τώρα στο διοικητικό συμβούλιο της εταιρείας βιοτεχνολογίας Sensyne Health και είναι ανώτερος σύμβουλος του Ιδρύματος Bill and Melinda Gates. Πριν από την ένταξή του στον MHRA, ο Hudson κατείχε διάφορες ανώτερες θέσεις στον φαρμακευτικό γίγαντα SmithKline Beecham.
Μεταρρυθμίσεις
Οι επικριτές υποστηρίζουν ότι τόσο μικρές όσο και μεγάλες διαρθρωτικές αλλαγές είναι απαραίτητες για να αποκατασταθεί η ικανότητα των ρυθμιστικών αρχών να λαμβάνουν ανεξάρτητες αποφάσεις, χωρίς επιρροή από τον βιομηχανικό κλάδο.
Ο Lexchin περιγράφει διάφορες μεταρρυθμίσεις για τις συμβουλευτικές επιτροπές, συμπεριλαμβανομένης της γνωστοποίησης όλων των οικονομικών συμφερόντων, συμπεριλαμβανομένου του ποσού της πληρωμής σε δολάρια, μαζί με μια εξήγηση σχετικά με το γιατί τα άτομα αυτά δεν μπορούν να αντικατασταθούν με κάποιον χωρίς συμφέροντα. Οι προτάσεις του Lexchin ευθυγραμμίζονται με τις μακροχρόνιες συστάσεις του Ινστιτούτου Ιατρικής των ΗΠΑ.
Ο Kesselheim λέει ότι ένα κρίσιμο βήμα είναι να επανεξετάσει ο FDA την προσέγγισή του για τις ταχείες εγκρίσεις. “Πρέπει να υπάρχει μεγαλύτερη σαφήνεια σχετικά με τα τελικά σημεία και ποια είναι η επιστημονική βάση για την επιλογή ενός τελικού σημείου”. Ο Kesselheim λέει ότι χρειάζονται μεγαλύτερες εγγυήσεις ότι τα τελικά σημεία που επιλέγονται είναι πραγματικά “εύλογα πιθανό” να προβλέπουν το κλινικό όφελος, όπως απαιτεί το πρότυπο της επιταχυνόμενης έγκρισης του FDA. Για τα φάρμακα με ταχεία έγκριση, “πρέπει επίσης να διασφαλιστεί ότι μια επιβεβαιωτική δοκιμή βρίσκεται σε εξέλιξη κατά τη στιγμή της έγκρισης, ώστε να μπορεί να ολοκληρωθεί εγκαίρως. Και αν δεν ολοκληρωθεί ή η δοκιμή είναι αρνητική, τότε πρέπει να σκεφτούμε πώς θα μπορούσαμε να αποσύρουμε το προϊόν”, λέει.
Ο Light λέει ότι δεν είναι πλέον δυνατό για τους γιατρούς και τους ασθενείς να λαμβάνουν αμερόληπτες, αυστηρές αξιολογήσεις από τις ρυθμιστικές αρχές φαρμάκων. Προτείνει τη δημιουργία μη κερδοσκοπικών οργανισμών όπως το Ινστιτούτο για την Ποιότητα και την Αποτελεσματικότητα στην Υγεία της Γερμανίας, το οποίο ιδρύθηκε για να διενεργεί αξιολογήσεις εγκεκριμένων φαρμάκων που είναι ανεξάρτητες από τη βιομηχανία, αυστηρές, αμερόληπτες και διαφανείς. “Το ερώτημα είναι γιατί οι ρυθμιστικές αρχές φαρμάκων δεν έκαναν εξαρχής αυτή την αξιόπιστη, διαφανή, αυστηρή και αμερόληπτη δουλειά;” λέει ο Light.
Ενώ ιστορικές καταστροφές στον τομέα των φαρμάκων, όπως η σουλφανιλαμίδη και η θαλιδομίδη, ανέβασαν το κύρος των ρυθμιστικών οργανισμών, ο Light υποστηρίζει ότι οι ρυθμιστικές αρχές χρειάζονται τώρα το δικό τους παρατηρητήριο και ζητά τη σύσταση μιας επιτροπής ασφάλειας φαρμάκων και εμβολίων, ανεξάρτητης από τη ρυθμιστική αρχή φαρμάκων, με την εξουσία, τη στελέχωση και τα κονδύλια για τη διερεύνηση περιστατικών βλάβης των ασθενών. “Οι χώρες έχουν ανεξάρτητα συμβούλια ασφαλείας για τις αεροπορικές εταιρείες και τους επιβάτες τους. Γιατί όχι και για τα φάρμακα και τους ασθενείς;” λέει ο Light.
Δεδομένα-παραπομπές
–Ταχύτητα, ασφάλεια και χρηματοδότηση της βιομηχανίας – Από την PDUFA I στην PDUFA VI
–Ανθυγιεινή φαρμακευτική νομοθεσία
–Επιτροπή Υγείας της Βουλής των Κοινοτήτων. Η επιρροή της φαρμακευτικής βιομηχανίας. 2005
–Ο εποπτικός φορέας υγείας της Αυστραλίας κατηγορείται για “πολύ στενή” σχέση με τη βιομηχανία
–Εμφυτεύματα πλέγματος: Γυναίκες εγείρουν αξιώσεις κατά των οργανισμών NHS και των χειρουργών για την αποτυχία προειδοποίησης των κινδύνων
–Το ελαττωματικό εμφύτευμα ισχίου αναδεικνύει τις αδυναμίες των κανονιστικών οργανισμών της ΕΕ
–Σύγκριση των ποσοστών των ζητημάτων ασφάλειας και της αναφοράς των αποτελεσμάτων των δοκιμών για τα ιατροτεχνολογικά προϊόντα που έχουν εγκριθεί στην Ευρωπαϊκή Ένωση και τις Ηνωμένες Πολιτείες: μελέτη κοόρτης
–Ο νόμος περί τέλους χρήσης συνταγογραφούμενων φαρμάκων – Πολύ περισσότερα από τα τέλη χρήσης
–ενημερωτικό δελτίο: Ο FDA με μια ματιά
–Σύγκρουση συμφερόντων μεταξύ των συμβούλων της κυβέρνησης του Ηνωμένου Βασιλείου για την covid-19
–Covid-19: Πόσο ανεξάρτητες ήταν οι συμβουλευτικές επιτροπές εμβολίων των ΗΠΑ και της Βρετανίας;
–Επανεξέταση των οικονομικών αντικρουόμενων συμφερόντων στις συμβουλευτικές επιτροπές του FDA
–TGA:Έγγραφα που δημοσιεύονται σύμφωνα με το άρθρο 11Γ του νόμου περί ελευθερίας των πληροφοριών του 1982, Ιούλιος 2020 – Ιούνιος 2021
–Ευρωπαϊκός Οργανισμός Φαρμάκων. Δημοσίευση κλινικών δεδομένων
–Health Canada. Αναζήτηση κλινικών πληροφοριών για φάρμακα και ιατροτεχνολογικά προϊόντα
–doctors4covidethics:Έγγραφα σχετικά με το TGA FOI 2289. 2021
–Εμβόλια και θεραπείες Covid-19: πρέπει να έχουμε πρωτογενή δεδομένα, τώρα
–Οι εμπειρογνώμονες τοποθετούνται μετά τη μήνυση κατά του FDA για πρόσβαση στα δεδομένα της δοκιμής της Pfizer
–Προθεσμίες αξιολόγησης φαρμάκων και προβλήματα ασφάλειας
–Η εποχή της ταχύτερης έγκρισης φαρμάκων από τον FDA έχει επίσης προκαλέσει αυξημένες προειδοποιήσεις και αποσύρσεις από την αγορά
–Συμβάντα ασφάλειας μετά τη διάθεση στην αγορά μεταξύ των νέων θεραπευτικών προϊόντων που εγκρίθηκαν από τον Οργανισμό Τροφίμων και Φαρμάκων των ΗΠΑ μεταξύ 2001 και 2010
–Θα πρέπει οι ρυθμιστικές αρχές να εγκρίνουν φάρμακα βάσει εναλλακτικών τελικών σημείων;
–Ενέκρινε το εμβόλιο της Moderna πριν από 6 μήνες. Τώρα, ο πρώην επικεφαλής του FDA Hahn εντάσσεται στον υποστηρίκτη της βιοτεχνολογίας
–Μελλοντικές θέσεις εργασίας των επιθεωρητών αιματολογίας-ογκολογίας του FDA
–Κατευθυντήριες γραμμές κλινικής πρακτικής που μπορούμε να εμπιστευτούμε
Ημερομηνία δημοσίευσης:16.07.2022
Follow us: