Κατά έναν περίεργο τρόπο, και παρόλο που η Ελλάδα έχει χορηγήσει ένα σημαντικό αριθμό δόσεων των πειραματικών εμβολίων κατά της covid-19, φαίνεται πως δεν αναφέρει διεξοδικά όλες τις ανεπιθύμητες ενέργειες.
Λαμβάνοντας υπόψιν τον πληθυσμό, τον αριθμό των δόσεων και συγκρίνοντας τα στοιχεία με χώρες αντίστοιχου προφίλ, η Ελλάδα και η Κύπρος φέρεται να μήν αναφέρουν τις παρενέργειες όπως οφείλουν σύμφωνα με τις Ευρωπαϊκές οδηγίες και κανονισμούς.
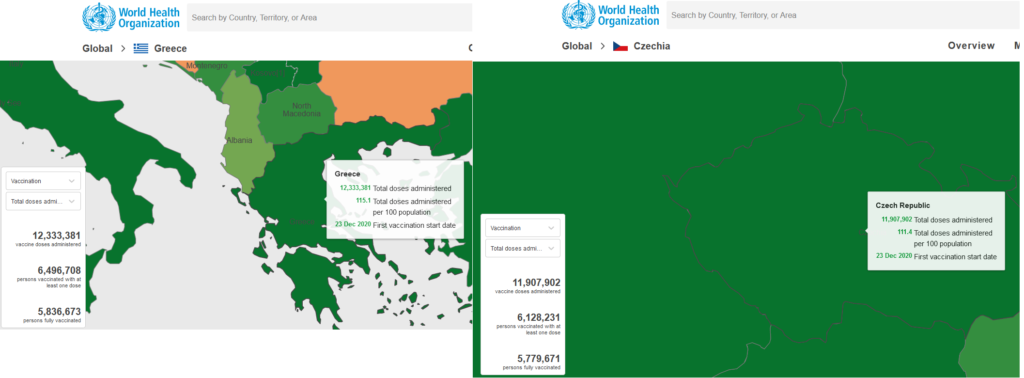
Για παράδειγμα, η Τσεχία με αντίστοιχο αριθμό εμβολιασμών(12.000.000) και κατοίκων σε σύγκριση με την Ελλάδα, έχει δηλώσει διπλάσιο αριθμό ανεπιθύμητων ενεργειών στον ΕΜΑ.
Στις 06.10.2021 αποστείλαμε επιστολή προς τον Ε.Ο.Φ. η οποία μέχρι και σήμερα(24.10.2021), παραμένει αναπάντητη. Η επιστολή μας έλαβε αριθμό πρωτοκόλλου.
———————————————————————
Αξιότιμη κυρία Κάπου,
μέχρι και τις 02.10.2021 και σύμφωνα πάντα με τα επίσημα στοιχεία απο την Ευρωπαϊκή βάση δεδομένων του ΕΜΑ (EudraVigilance) για τις ανεπιθύμητες ενέργειες των φαρμακευτικών σκευασμάτων, για τα 4 εμβόλια κατά της νόσου Covid-19 που κυκλοφορούν στην Ευρωπαϊκή αγορά έχουν πραγματοποιηθεί 1.014.252 αναφορές που περιλαμβάνουν 296.669 σοβαρές ανεπιθύμητες ενέργειες και 15.544 θανάτους που σχετίζονται με τα ακόλουθα σκευάσματα:
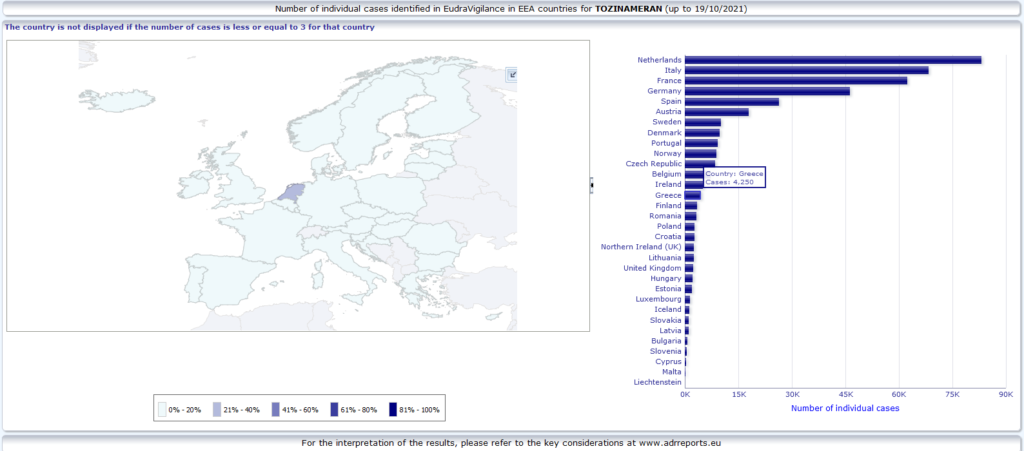
COVID-19 MRNA VACCINE PFIZER-BIONTECH (TOZINAMERAN) -> συνολικά 470.776 αναφορές (οι 3.966 απο την Ελλάδα), 137714 σοβαρές ανεπιθύμητες ενέργειες, 7.622 θάνατοι
COVID-19 VACCINE ASTRAZENECA (CHADOX1 NCOV-19) -> συνολικά 386.177 αναφορές (οι 1.629 απο την Ελλάδα), 102.362 σοβαρές ανεπιθύμητες ενέργειες, 3.420 θάνατοι
COVID-19 MRNA VACCINE MODERNA (CX-024414) -> συνολικά 127.578 αναφορές (οι 371 απο την Ελλάδα), 46.868 σοβαρές ανεπιθύμητες ενέργειες , 3.869 θάνατοι
COVID-19 VACCINE JANSSEN (AD26.COV2.S) -> συνολικά 29.721 αναφορές (οι 150 απο την Ελλάδα), 9.725 σοβαρές ανεπιθύμητες ενέργειες , 633 θάνατοι
Θεωρούμε επίσης σκόπιμο να τονίσουμε οτι μέχρι και τις 02.10.2021 έχουν αναφερθεί 3.225 σοβαρές ανεπιθύμητες ενέργειες σε παιδιά ηλικίας 0-17 ετών καθώς και 45 θάνατοι.
Υπάρχουν πλέον εκατοντάδες δημοσιεύματα στον Ελληνικό τύπο που αναφέρονται σε νεκρούς μερικές ημέρες ή και ώρες μετά τη λήψη των προαναφερθέντων σκευασμάτων κατα της covid-19.
Μάλιστα υπάρχουν τουλάχιστον 3 διαφορετικά δημοσιεύματα σε τοπικό τύπο που αναφέρονται σε θάνατο υγειών παιδιών, ελάχιστες ώρες μετά τη ληψη της δόσης συγκεκριμένου σκευάσματος.
Στο παρακάτω λίνκ θα βρείτε την εξαγωγή ολόκληρης της βάσης δεδομένων του ΕΜΑ (μέχρι και τις 02.10.2021) και το αρχείο σε μορφή csv (comma-separated values) περιέχει όλες τις λεπτομέρειες των αναφορών που μπορεί να εξάγει κανείς απο τη συγκεκριμένη βάση (αριθμός αναφοράς, ηλικία,παρενέργειες, λινκ στο αυθεντικό αρχείο ICSR κλπ). Η βάση έχει ελεγχθεί για διπλές εγγραφές.
http://www.eyewideopen.org/downloads/cases_02_10_21.zip
Σύμφωνα με τις πρακτικές, Κριτήρια Σοβαρότητας Ανεπιθύμητης Ενέργειας αποτελούν:
- Θάνατος
- Άμεση απειλή για τη ζωή
- Πρόκληση ή παράταση νοσηλείας
- Πρόκληση εμμένουσας ή σημαντικής αναπηρίας ή ανικανότητας
- Συγγενής Ανωμαλία / βλάβη κατά τον τοκετό
- Σημαντικό ιατρικό συμβάν
Μιάς και η βάση του ΕΜΑ δέν αναφέρει αναλυτικά τη χώρα προέλευσης για κάθε αναφορά, θα θέλαμε να μας πληροφορήσετε ποιες απο τις παραπάνω αναφορές (με αριθμό αναφοράς) προέρχονται απο τον Ελλαδικό χώρο, όπως κάνουν αρκετές Ευρωπαϊκές χώρες που δημοσιεύουν τα στατιστικά της φαρμακοεπαγρύπνησής τους.
Θα σας παρακαλούσαμε επίσης να μας προσφέρετε αναλυτικά στοιχεία των ανεπιθύμητων ενεργειών στην Ελλάδα, κατηγοριοποιημένα σύμφωνα με τα παραπάνω αναφερθέντα κριτήρια χωρισμένα σε ηλικιακές ομάδες (στο πρότυπο της EudraVigilance).
Επιπλέον θα σας παρακαλούσαμε να μας απαντήσετε, όπως ορίζει ο νόμος (άρθρο 4 του Ν2690/ 1999 ΚΔΔ), στις κάτωθι ερωτήσεις:
Α. Πώς ακριβώς έχει ενημερώσει ο ΕΟΦ τα μέλη των ιατρικών ενώσεων για τη φαρμακοεπαγρύπνηση στην Ελλάδα;
B. Πότε πραγματοποιήθηκε η τελευταία ενημέρωση των επιστημόνων μέσω σεμιναρίων και ολοκληρωμένης εκστρατείας ενημέρωσης και σε ποιό βαθμό ολοκλήρωσε ο ΕΟΦ τις απαιτήσεις του προγράμματος SCOPE (Strengthening Collaboration for Operating Pharmacovigilance in Europe);
Γ. Σε συνέχεια της εφαρμογής της νέας νομοθεσίας για την αναφορά όλων των ανεπιθύμητων ενεργειών, οι Κάτοχοι Άδειας Κυκλοφορίας φαρμακευτικών προϊόντων πρέπει να αντικαταστήσουν στα διαφημιστικά τους έντυπα ή έντυπα προώθησης των προϊόντων τους το κείμενο που αφορά την “κίτρινη κάρτα”. Κατα πόσον ελέγχει ο ΕΟΦ την τήρηση απο τις φαρμακευτικές εταιρείες του νόμου; Μέχρι στιγμής, δεν έχουμε δει σε καμία διαφήμιση των κατασκευαστών εμβολίων covid, το συγκεκριμένο κείμενο σε κίτρινο πλαίσιο. http://www.eof.gr/assets/ADR_Yellow_Box.pdf
Δ. Έχει μέχρι σήμερα πραγματοποιηθεί απο τον ΕΟΦ αξιολόγηση οφέλους-κινδύνου όπως ορίζει ο “Οδηγός Καλών Πρακτικών στη Φαρμακοεπαγρύπνηση” του Συνδέσμου Φαρμακευτικών Eπιχειρήσεων Eλλάδος; Με ποιό αποτέλεσμα;
https://sfee.gr/wp-content/uploads/2019/11/Odigos-farmakoepagripnisis.pdf
Ε. Γίνεται συλλογή και διασταύρωση στοιχείων απο τοπικά ΜΜΕ καθώς και απο Μέσα Κοινωνικής Δικτύωσης όπως ορίζει ο παραπάνω οδηγός ώστε να υπάρξει μια ολοκληρωμένη εικόνα και σχετική παρακολούθηση των ανεπιθύμητων ενεργειών ενός φαρμακευτικού προϊόντος;
ΣΤ. Σύμφωνα με το νόμο, η εταιρεία παραγωγής ενός φαρμακευτικού προϊόντος πρέπει να δηλώσει έναν μόνιμο αντιπρόσωπο στη χώρα διάθεσης του συγκεκριμένου προϊόντος. Δεδομένου οτι τα συμβόλαια που έχουν υπογραφεί αφορούν και την εταιρεία BioNTech, η συγκεκριμένη εταιρεία έχει αντιπρόσωπο στην Ελλάδα ώστε να συμμετέχει επιτυχώς στο πρόγραμμα της φαρμακοεπαγρύπνησης;
Ζ. Ο Χορηγός βάσει νόμου υποχρεούται να υποβάλλει στο Τμήμα Φαρμακοεπαγρύπνησης του ΕΟΦ, κατάλογο (line listing) όλων των Ύποπτων Απροσδόκητων Σοβαρών Ανεπιθύμητων Ενεργειών (SUSAR) που έχουν εμφανιστεί παγκοσμίως σε σχέση με το ερευνητικό προϊόν που χορηγείται στα πλαίσια παρεμβατικής κλινικής δοκιμής στην Ελλάδα. Η υποβολή των ΕΠΠΑ (Έκθεση Περιοδικής Παρακολούθησης Ασφάλειας) στο Τμήμα Φαρμακοεπαγρύπνησης του ΕΟΦ, για κάθε προϊόν με άδεια κυκλοφορίας στην Ελλάδα, πρέπει να γίνεται ως εξής:
• Πριν το προϊόν τεθεί σε κυκλοφορία για πρώτη φορά στην αγορά κάποιας χώρας της Ευρωπαϊκής Ένωσης: – Όποτε ζητηθεί από τον ΕΟΦ.
– Μετά την λήψη αδείας κυκλοφορίας στην Ελλάδα και έως την στιγμή που το προϊόν τεθεί σε κυκλοφορία στην αγορά κάποιας χώρας του ΕΟΧ, ο Κάτοχος Άδειας Κυκλοφορίας παράγει και υποβάλει εξαμηνιαίες ΕΠΠΑ του προϊόντος στον ΕΟΦ.
• Μετά την στιγμή που το προϊόν τεθεί σε κυκλοφορία για πρώτη φορά στην αγορά κάποιας χώρας του ΕΟΧ:
– Η Εταιρεία υποχρεούται να συνεχίσει την υποβολή των εξαμηνιαίων ΕΠΠΑ, έως ότου συμπληρωθούν δυο χρόνια εμπειρίας μετά από τη στιγμή που το προϊόν τέθηκε σε κυκλοφορία για πρώτη φορά στην αγορά κάποιας χώρας του ΕΟΧ.
Έχει μέχρι στιγμής ο ΕΟΦ ζητήσει από τις φαρμακευτικές εταιρείες/κατασκευαστές την υποβολή των ΕΠΠΑ; Έχουν οι εταιρείες παραγωγής των συγκεκριμένων εμβολίων υποβάλει την εξαμηνιαία ΕΠΠΑ και αν ναι, θα θέλαμε να μας την παρέχετε.
Η. Τα τελευταία δημοσιευμένα στατιστικά στοιχεία του Τμήματος Ανεπιθύμητων Ενεργειών αφορούν την περίοδο 2004-2007. Θα παρακαλούσαμε το τμήμα ΤΑΕ (σε C.C.) να μας αποστείλει τα τελευταία στατιστικά στοιχεία που αφορούν την περίοδο 2019-σήμερα.
Παρακαλούμε όπως πρωτοκολληθεί το παρόν και μας στείλετε τον αριθμό πρωτοκόλλου της υπηρεσίας σας.
Σας ευχαριστούμε εκ των προτέρων
Με εκτίμηση
Εκ μέρους των Ε.Υ.Ε
