Το 2020, πριν από την κυκλοφορία του “εμβολίου” COVID-19, η Brighton Collaboration δημιούργησε έναν κατάλογο προτεραιότητας, ο οποίος εγκρίθηκε από τον Παγκόσμιο Οργανισμό Υγείας, των πιθανών ανεπιθύμητων ενεργειών που σχετίζονται με τα εμβόλια COVID-19. Στη πρόσφατη (31.08.2022) μελέτη που δημοσιεύτηκε και με την συμμετοχή του Peter Doshi (senior editor στο BMJ) προσαρμόστηκε ο κατάλογος της Brighton Collaboration για την αξιολόγηση σοβαρών ανεπιθύμητων ενεργειών ειδικού ενδιαφέροντος που παρατηρήθηκαν σε δοκιμές εμβολίων mRNA COVID-19.
Αποτελέσματα
Τα “εμβόλια” Pfizer/BioNTech και Moderna mRNA COVID-19 συσχετίστηκαν με υπερβολικό κίνδυνο σοβαρών ανεπιθύμητων ενεργειών ειδικού ενδιαφέροντος (AESI) 10,1 και 15,1 ανά 10.000 εμβολιασθέντες σε σχέση με τις βασικές τιμές του εικονικού φαρμάκου 17,6 και 42,2 (95 % CI -0,4 έως 20,6 και -3,6 έως 33,8), αντίστοιχα. Συνδυαστικά, τα εμβόλια mRNA συσχετίστηκαν με αυξημένο κίνδυνο σοβαρών ανεπιθύμητων ενεργειών ειδικού ενδιαφέροντος 12,5 ανά 10.000 εμβολιασθέντες (95 % CI 2,1 έως 22,9)- λόγος κινδύνου 1,43 (95 % CI 1,07 έως 1,92). Η μελέτη της Pfizer παρουσίασε 36 % υψηλότερο κίνδυνο σοβαρών ανεπιθύμητων συμβάντων στην ομάδα του εμβολίου- διαφορά κινδύνου 18,0 ανά 10.000 εμβολιασθέντες (95 % CI 1,2 έως 34,9)- λόγος κινδύνου 1,36 (95 % CI 1,02 έως 1,83). Η έρευνα της Moderna παρουσίασε 6 % υψηλότερο κίνδυνο σοβαρών ανεπιθύμητων συμβάντων στην ομάδα του εμβολίου: διαφορά κινδύνου 7,1 ανά 10.000 (95 % CI -23,2 έως 37,4)- λόγος κινδύνου 1,06 (95 % CI 0,84 έως 1,33). Συνδυαστικά, υπήρχε 16 % υψηλότερος κίνδυνος σοβαρών ανεπιθύμητων συμβάντων στους λήπτες του εμβολίου mRNA: διαφορά κινδύνου 13,2 (95 % CI -3,2 έως 29,6)- λόγος κινδύνου 1,16 (95 % CI 0,97 έως 1,39).
Εντοπίστηκαν πίνακες σοβαρών ανεπιθύμητων ενεργειών για καθεμία από τις δοκιμές εμβολίων που υποβλήθηκαν για έγκριση (EUA) σε ενήλικες (ηλικίας 16+ για την Pfizer, 18+ για την Moderna) στις Ηνωμένες Πολιτείες: BNT162b2 (NCT04368728) και το εμβόλιο mRNA-1273 της Moderna COVID-19 (NCT04470427).
| Trial | Data cutoff date | Journal articles | FDA sources | Health Canada sources |
|---|---|---|---|---|
| Pfizer trial in ages 16 and above (NCT04368728) | 14 Nov 2020 (supported Dec 2020 EUA) | Aggregate data only | Table 23 in sponsor briefing document | Table 55 in sponsor document C4591001 Final Analysis Interim Report Body |
| Moderna trial in ages 18 and above (NCT04470427) | 25 Nov 2020 (supported Dec 2020 EUA) | Table S11 in publication | Table 27 in sponsor briefing document | Table 14.3.1.13.3 in sponsor document mRNA-1273-P301 Unblinded Safety Tables Batch 1 (DS2) |
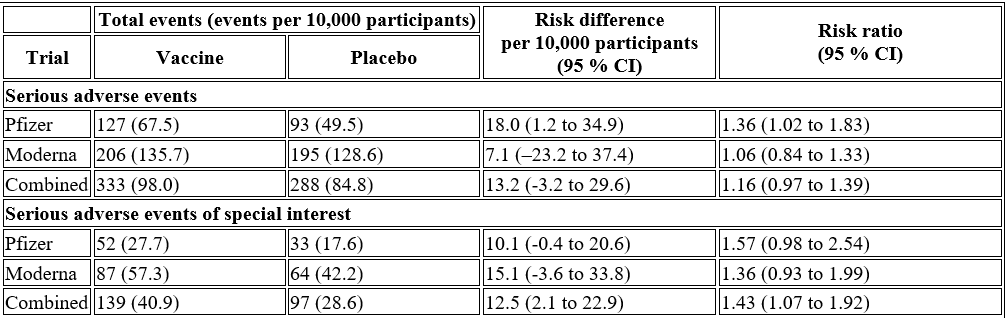
Σοβαρά ανεπιθύμητα συμβάντα ειδικού ενδιαφέροντος
Σοβαρά ανεπιθύμητα συμβάντα ειδικού ενδιαφέροντος
Όσον αφορά το κατά πόσον κάθε τύπος SAE περιλαμβανόταν στον κατάλογο AESI της SPEAC, η συμφωνία μεταξύ των δύο ανεξάρτητων κλινικών ερευνητών ήταν 86 % (281/325)- 40 από τις 44 διαφωνίες επιλύθηκαν με συναίνεση και μόνο τέσσερις διαφωνίες κατέστησαν αναγκαία την προσφυγή τρίτου κλινικού ερευνητή. Ο Συμπληρωματικός Πίνακας 1 περιλαμβάνει τον πλήρη κατάλογο των συμπεριληφθέντων και αποκλεισθέντων SAEs και στις δύο δοκιμές.
Στη δοκιμή της Pfizer, 52 σοβαρές ΑΕΕ (27,7 ανά 10.000) αναφέρθηκαν στην ομάδα του εμβολίου και 33 (17,6 ανά 10.000) στην ομάδα του εικονικού φαρμάκου. Η διαφορά αυτή αντιστοιχεί σε 57 % υψηλότερο κίνδυνο σοβαρών AESI (RR 1,57 95 % CI 0,98 έως 2,54) και σε διαφορά κινδύνου 10,1 σοβαρών AESI ανά 10.000 εμβολιασμένους συμμετέχοντες (95 % CI -0,4 έως 20,6). Στη μελέτη Moderna, αναφέρθηκαν 87 σοβαρές AESI (57,3 ανά 10.000) στην ομάδα του εμβολίου και 64 (42,2 ανά 10.000) στην ομάδα του εικονικού φαρμάκου. Η διαφορά αυτή αντιστοιχεί σε 36 % υψηλότερο κίνδυνο σοβαρών AESI (RR 1,36 95 % CI 0,93 έως 1,99) και σε διαφορά κινδύνου 15,1 σοβαρών AESI ανά 10.000 εμβολιασμένους συμμετέχοντες (95 % CI -3,6 έως 33,8). Συνδυάζοντας τις δοκιμές, υπήρξε 43 % υψηλότερος κίνδυνος σοβαρής AESI (RR 1,43, 95 % CI 1,07 έως 1,92) και διαφορά κινδύνου 12,5 σοβαρής AESI ανά 10.000 εμβολιασμένους συμμετέχοντες (95 % CI 2,1 έως 22,9). (Πίνακας 2).
Από τις 236 σοβαρές AESI που εμφανίστηκαν σε όλες τις δοκιμές της Pfizer και της Moderna, το 97 % (230/236) ήταν τύποι ανεπιθύμητων συμβάντων που συμπεριλήφθηκαν ως AESI επειδή παρατηρούνται με το COVID-19. Τόσο στις δοκιμές της Pfizer όσο και της Moderna, ο υψηλότερος κίνδυνος υπέρβασης εμφανίστηκε μεταξύ της κατηγορίας διαταραχών της πήξης του Brighton. Οι καρδιακές διαταραχές αποτέλεσαν κεντρικό θέμα ανησυχίας για τα εμβόλια mRNA- στη δοκιμή Pfizer εμφανίστηκαν περισσότερες καρδιαγγειακές AESIs στην ομάδα του εμβολίου από ό,τι στην ομάδα του εικονικού φαρμάκου, αλλά στη δοκιμή Moderna οι ομάδες διέφεραν μόνο κατά 1 περίπτωση. (Πίνακας 3, πίνακας 4).
| Brighton category | Vaccine | Placebo | Vaccine events per 10,000 | Placebo events per 10,000 | Difference in events per 10,000 | Risk ratio |
|---|---|---|---|---|---|---|
| Association with immunization in general | ||||||
| Anaphylaxis | 1 | 1 | 0.5 | 0.5 | 0.0 | 1.00 |
| Association with specific vaccine platform(s) | ||||||
| Encephalitis/encephalomyelitis | 0 | 2 | 0.0 | 1.1 | −1.1 | 0.00 |
| Seen with COVID-19 | ||||||
| Acute kidney injury | 2 | 0 | 1.1 | 0.0 | 1.1 | N/A |
| Acute liver injury | 0 | 1 | 0.0 | 0.5 | −0.5 | 0.00 |
| Acute respiratory distress syndrome | 2 | 1 | 1.1 | 0.5 | 0.5 | 2.00 |
| Coagulation disorder | 16 | 10 | 8.5 | 5.3 | 3.2 | 1.60 |
| Myocarditis/pericarditis | 2 | 1 | 1.1 | 0.5 | 0.5 | 2.00 |
| Other forms of acute cardiac injury | 16 | 12 | 8.5 | 6.4 | 2.1 | 1.33 |
| Subtotal | 39 | 28 | 20.7 | 14.9 | 5.8 | 1.39 |
| Brighton list of 29 clinical diagnoses seen with COVID-19 | ||||||
| Abscess | 4 | 1 | 2.1 | 0.5 | 1.6 | 4.00 |
| Cholecystitis | 4 | 2 | 2.1 | 1.1 | 1.1 | 2.00 |
| Colitis/Enteritis | 1 | 1 | 0.5 | 0.5 | 0.0 | 1.00 |
| Diarrhea | 1 | 0 | 0.5 | 0.0 | 0.5 | N/A |
| Hyperglycemia | 1 | 1 | 0.5 | 0.5 | 0.0 | 1.00 |
| Pancreatitis | 1 | 0 | 0.5 | 0.0 | 0.5 | N/A |
| Psychosis | 1 | 0 | 0.5 | 0.0 | 0.5 | N/A |
| Subtotal | 13 | 5 | 6.9 | 2.7 | 4.3 | 2.60 |
| Total | 52 | 33 | 27.7 | 17.6 | 10.1 | 1.57 |
| Brighton category | Vaccine | Placebo | Vaccine events per 10,000 | Placebo events per 10,000 | Difference in events per 10,000 | Risk ratio |
|---|---|---|---|---|---|---|
| Association with specific vaccine platform(s) | ||||||
| Bell’s Palsy | 1 | 0 | 0.7 | 0.0 | 0.7 | N/A |
| Encephalitis/encephalomyelitis | 1 | 0 | 0.7 | 0.0 | 0.7 | N/A |
| Seen with COVID-19 | ||||||
| Acute kidney injury | 1 | 3 | 0.7 | 2.0 | −1.3 | 0.33 |
| Acute liver injury | 1 | 0 | 0.7 | 0.0 | 0.7 | N/A |
| Acute respiratory distress syndrome | 7 | 4 | 4.6 | 2.6 | 2.0 | 1.75 |
| Angioedema | 0 | 2 | 0.0 | 1.3 | −1.3 | 0.00 |
| Coagulation disorder | 20 | 13 | 13.2 | 8.6 | 4.6 | 1.54 |
| Generalized Convulsions | 2 | 0 | 1.3 | 0.0 | 1.3 | N/A |
| Myelitis | 0 | 1 | 0.0 | 0.7 | −0.7 | 0.00 |
| Myocarditis/pericarditis | 4 | 5 | 2.6 | 3.3 | −0.7 | 0.80 |
| Other forms of acute cardiac injury | 26 | 26 | 17.1 | 17.1 | 0.0 | 1.00 |
| Other rash | 1 | 1 | 0.7 | 0.7 | 0.0 | 1.00 |
| Rhabdomyolysis | 0 | 1 | 0.0 | 0.7 | −0.7 | 0.00 |
| Single Organ Cutaneous Vasculitis | 1 | 0 | 0.7 | 0.0 | 0.7 | N/A |
| Subtotal | 65 | 56 | 42.8 | 36.9 | 5.9 | 1.16 |
| Brighton list of 29 clinical diagnoses seen with COVID-19 | ||||||
| Abscess | 1 | 0 | 0.7 | 0.0 | 0.7 | N/A |
| Arthritis | 3 | 1 | 2.0 | 0.7 | 1.3 | 3.00 |
| Cholecystitis | 4 | 0 | 2.6 | 0.0 | 2.6 | N/A |
| Colitis/Enteritis | 6 | 3 | 4.0 | 2.0 | 2.0 | 2.00 |
| Diarrhea | 2 | 1 | 1.3 | 0.7 | 0.7 | 2.00 |
| Hyperglycemia | 1 | 0 | 0.7 | 0.0 | 0.7 | N/A |
| Hyponatremia | 1 | 1 | 0.7 | 0.7 | 0.0 | 1.00 |
| Pancreatitis | 2 | 0 | 1.3 | 0.0 | 1.3 | N/A |
| Pneumothorax | 0 | 1 | 0.0 | 0.7 | −0.7 | 0.00 |
| Psychosis | 1 | 1 | 0.7 | 0.7 | 0.0 | 1.00 |
| Thyroiditis | 1 | 0 | 0.7 | 0.0 | 0.7 | N/A |
| Subtotal | 22 | 8 | 14.5 | 5.3 | 9.2 | 2.75 |
| Total | 87 | 64 | 57.3 | 42.2 | 15.1 | 1.36 |
Στη μελέτη Moderna, ο πρόσθετος κίνδυνος σοβαρών AESIs (15,1 ανά 10.000 συμμετέχοντες) ήταν υψηλότερος από τη μείωση του κινδύνου νοσηλείας στο COVID-19 σε σχέση με την ομάδα εικονικού φαρμάκου (6,4 ανά 10.000 συμμετέχοντες). Στη δοκιμή Pfizer, ο υπερβολικός κίνδυνος σοβαρών AESIs (10,1 ανά 10.000) ήταν υψηλότερος από τη μείωση του κινδύνου για νοσηλεία με COVID-19 σε σχέση με την ομάδα εικονικού φαρμάκου (2,3 ανά 10.000 συμμετέχοντες).
Χρησιμοποιώντας έναν προκαθορισμένο κατάλογο AESI που προσδιορίστηκε από τη Brighton, παρατηρήθηκε υψηλότερος κίνδυνος σοβαρών AESI στην ομάδα του εμβολίου mRNA COVID-19 σε σχέση με το εικονικό φάρμακο τόσο στις μελέτες φάσης ΙΙΙ της Pfizer όσο και της Moderna για ενήλικες, με 10,1 (Pfizer) και 15,1 (Moderna) πρόσθετα συμβάντα για κάθε 10.000 άτομα που εμβολιάστηκαν. Συνδυαστικά, υπήρξε διαφορά κινδύνου 12,5 σοβαρών AESIs ανά 10.000 άτομα που εμβολιάστηκαν (95 % CI 2,1 έως 22,9). Τα αποτελέσματα αυτά εγείρουν ανησυχίες ότι τα εμβόλια mRNA σχετίζονται με μεγαλύτερη βλάβη από ό,τι είχε αρχικά εκτιμηθεί κατά τη στιγμή της επείγουσας έγκρισης. Επιπλέον, η ανάλυσή μας εντόπισε 36 % υψηλότερο κίνδυνο σοβαρών ανεπιθύμητων ενεργειών στους εμβολιασμένους συμμετέχοντες στη δοκιμή της Pfizer: 18,0 πρόσθετα SAEs ανά 10.000 εμβολιασθέντες (95 % CI 1,2 έως 34,9).
Η μελέτη μας έχει αρκετούς σημαντικούς περιορισμούς. Πρώτον, η δοκιμή της Pfizer δεν ανέφερε SAEs που συνέβησαν μετά από 1 μήνα μετά τη δόση 2. Αυτό το όριο αναφοράς μπορεί να οδήγησε σε υποεκτίμηση των σοβαρών AESI στη δοκιμή της Pfizer. Δεύτερον, και για τις δύο μελέτες, ο περιορισμένος χρόνος παρακολούθησης απέτρεψε την ανάλυση της σχέσης βλάβης-οφέλους για μεγαλύτερο χρονικό διάστημα. Τρίτον, όλα τα περιστατικά SAE στην ανάλυσή μας πληρούσαν τον κανονιστικό ορισμό του σοβαρού ανεπιθύμητου συμβάντος, αλλά πολλοί τύποι ανεπιθύμητων συμβάντων που ο ίδιος ο ασθενής μπορεί να κρίνει ως σοβαρά μπορεί να μην πληρούν αυτό το κανονιστικό όριο. Τέταρτον, οι αποφάσεις σχετικά με το ποια SAEs πρέπει να συμπεριληφθούν ή να αποκλειστούν ως AESIs απαιτούν υποκειμενικές, κλινικές κρίσεις ελλείψει λεπτομερών κλινικών πληροφοριών σχετικά με τα πραγματικά SAEs. Ενθαρρύνουμε την επανάληψη της μελέτης μας από τρίτους, με πρόσβαση σε πλήρη περιστατικά SAE, για να προσδιορίσουμε το βαθμό στον οποίο οι αποφάσεις αυτές επηρέασαν τα ευρήματά μας.
Τονίζουμε ότι η έρευνά μας είναι προκαταρκτική, για να επισημάνουμε την ανάγκη για πιο εμπεριστατωμένη ανάλυση. Οι κίνδυνοι σοβαρών AESIs στις δοκιμές αντιπροσωπεύουν μόνο τους μέσους όρους των ομάδων. Οι περιπτώσεις SAE είναι απίθανο να κατανέμονται εξίσου στις δημογραφικές υποομάδες που συμμετείχαν στη δοκιμή και οι κίνδυνοι μπορεί να είναι σημαντικά μικρότεροι σε ορισμένες ομάδες σε σύγκριση με άλλες. Συνεπώς, η γνώση των πραγματικών δημογραφικών στοιχείων εκείνων που παρουσίασαν αύξηση των σοβαρών AESI στην ομάδα του εμβολίου είναι απαραίτητη για μια σωστή ανάλυση βλάβης-οφέλους. Επιπλέον, απαιτούνται κλινικές μελέτες για να διαπιστωθεί εάν συγκεκριμένες SAE μπορούν να συνδεθούν με συγκεκριμένα συστατικά του εμβολίου σε αντίθεση με αναπόφευκτες συνέπειες της έκθεσης σε πρωτεΐνη ακίδας, καθώς τα μελλοντικά εμβόλια θα μπορούσαν στη συνέχεια να τροποποιηθούν αναλόγως ή να ελεγχθούν εκ των προτέρων οι ευαισθησίες. Παράλληλα, θα πρέπει να διενεργηθεί συστηματική ανασκόπηση και μετα-ανάλυση με τη χρήση ατομικών δεδομένων των συμμετεχόντων για να εξεταστούν τα ζητήματα βλάβης-οφέλους σε διάφορες δημογραφικές υποομάδες, ιδίως σε εκείνους που διατρέχουν χαμηλό κίνδυνο σοβαρών επιπλοκών από το COVID-19. Τέλος, υπάρχει επιτακτική ανάγκη για σύγκριση των SAE και της σχέσης βλάβης-οφέλους για διαφορετικούς τύπους εμβολίων- έχουν ήδη αρχίσει κάποιες πρώτες εργασίες προς αυτή την κατεύθυνση.
Απαιτείται πλήρης διαφάνεια των δεδομένων των κλινικών δοκιμών του εμβολίου COVID-19 για την ορθή αξιολόγηση αυτών των ερωτημάτων. Δυστυχώς, καθώς πλησιάζουμε 2 χρόνια μετά την κυκλοφορία των εμβολίων COVID-19, τα δεδομένα σε επίπεδο συμμετεχόντων παραμένουν απρόσιτα.
Follow us: