Καθώς ο Ευρωπαϊκός Οργανισμός Φαρμάκων συνεχίζει να μην παρέχει αναλυτικά τα στοιχεία ανά χώρα, αποστείλαμε στις 29 Ιανουαρίου 2022 επιστολή στον Ευρωπαϊκό οργανισμό με όλα τα δεδομένα(που έχουμε εξάγει από τη βάση των δεδομένων του) και ζητήσαμε να μας αναφέρουν τη χώρα προέλευσης κάθε αναφοράς. Με καθυστέρηση 3 μηνών, μας απάντησαν.

Ο EMA ενεργεί ως ιδιωτική εταιρεία (στις απαντήσεις τους μας αναφέρει ότι ακολουθεί ένα “business plan”) , ο ΕΟΦ φαίνεται να μην εκτελεί το καθήκον του όπως θα έπρεπε (έλλειψη προσωπικού; έλλειψη τεχνικού εξοπλισμού; πολιτική απόφαση; απλή αδιαφορία;). Τα στοιχεία που δημοσιεύει ο ΕΟΔΥ και το υπουργείο Υγείας φαίνεται να τα επεξεργάστηκαν ερασιτέχνες ή άνθρωποι που έχουν ελάχιστη γνώση στατιστικής. Το χάος συνεχίζεται με αμείωτο ρυθμό και μετά από 2 χρόνια “πανδημίας”, οι κρατικοί φορείς και οι ανεύθυνοι “υπεύθυνοι” συνεχίζουν να μην απαντούν.
Η ανακοίνωση του ΕΟΦ
Σύμφωνα με τα στοιχεία του ΕΜΑ, μέχρι και τα τέλη Ιανουαρίου, υπήρξαν στον Ελλαδικό χώρο 7.245 αναφορές ανεπιθύμητων ενεργειών στην Ευρωπαϊκή βάση δεδομένων Eudravigilance για τα 4 πειραματικά σκευάσματα κατά της Covid-19. Από αυτές τις αναφορές, οι 144 ήταν θανατηφόρες.
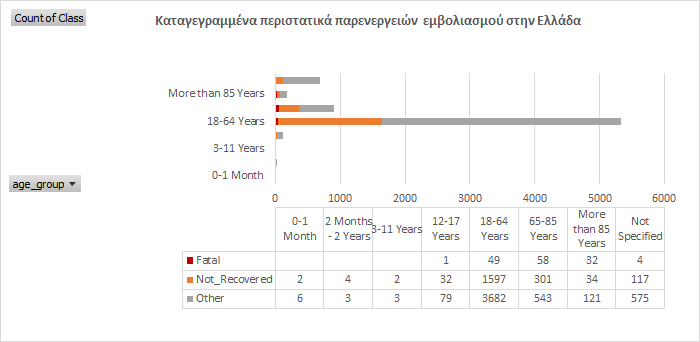
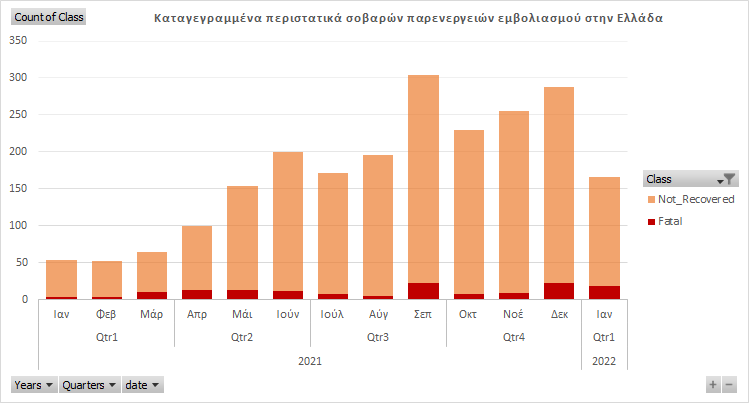
Ο Ε.Ο.Φ δημοσίευσε πρόσφατα (07.04.2022) την πρώτη ανάλυση(μετά απο 1+ χρόνο χορήγησης των πειραματικών σκευασμάτων) των δεδομένων φαρμακοεπαγρύπνησης στη χώρα μας με τίτλο “Συγκεντρωτικά στοιχεία Ε.Ο.Φ. για αναφορές στην Ελλάδα πιθανολογούμενων ανεπιθύμητων ενεργειών εμβολίων COVID -19 από την έναρξη χορήγησης των εμβολίων στην Ελλάδα έως 26.12.2021“. Η τελευταία ανάλυση αντίστοιχων δεδομένων που έχει πραγματοποιήσει και δημοσιεύσει ο οργανισμός, ήταν το 2007.
Σημαντικό είναι να αναφέρουμε ότι ο ΕΟΦ είναι ο μοναδικός ελεγκτικός κρατικός οργανισμός στην Ευρώπη που αναφέρει και επαναλαμβάνει, στη μοναδική του αναφορά, τις λέξεις “εικαζόμενες” και “πιθανολογούμενες” (όσον αφορά τις ανεπιθύμητες ενέργειες) τόσες πολλές φορές και σε τέτοια συχνότητα. Ο οργανισμός, που χρηματοδοτείται από τους φορολογούμενους της χώρας, προσπαθεί να μας πείσει ότι πρόκειται για “εικασίες”, συνεχίζοντας να αγνοεί τις επιστολές μας και τις ερωτήσεις μας. Εδώ να τονίσουμε ότι, σε συνεργασία με νομικούς εντός και εκτός Ελλάδος, ετοιμάζουμε να κινηθούμε νομικά κατά του οργανισμού και διαφόρων υπαλλήλων που, ενώ γνωρίζουμε ότι έχουν διαβάσει τις επιστολές μας, απλά τις αγνοούν.
Με την αδιαφορία προσπαθεί ο ΕΟΦ να μας πείσει;
Σύγκριση των δεδομένων ΕΟΦ-ΕΜΑ
Από την έναρξη της χορήγησης των προϊόντων κατά της Covid μέχρι και 26.12.2021, διανεμήθηκαν συνολικά 16.993.166 δόσεις.
- Comirnaty (BioNTech Manufacturing GmbH): 13.481.160
- Spikevax (Moderna Biotech Spain S.L): 1.311.776
- Vaxzevria (AstraZeneca AB): 1.546.581
- Janssen (Janssen-Cilag International NV): 653.649
Στα παιδιά/εφήβους ηλικίας 12-17 ετών, έχουν χορηγηθεί 421.914 δόσεις (208.478+213.436).
Στην ηλικιακή ομάδα 18-29 ετών έχουν χορηγηθεί 682.683 δόσεις (326.111+356.507).
Ακολουθεί ο συγκριτικός πίνακας των δεδομένων του Ευρωπαϊκού Οργανισμού Φαρμάκων (ΕΜΑ) και του Εθνικού Οργανισμού Φαρμάκων (ΕΟΦ). Τα δεδομένα του ΕΜΑ προέρχονται από την αίτησή μας για αποστολή των δεδομένων και του ΕΟΦ προέρχονται από την πρόσφατη ανακοίνωση για τα στοιχεία φαρμακοεπαγρύπνησης των προϊόντων κατά της COVID-19.
| Οργανισμός | ΕΟΦ | ΕΜΑ |
| Ημερομηνία αναφορών | από έναρξη εμβολιασμών μέχρι 26.12.2021 | 04.01.2021-28.01.2022 |
| Σύνολο αναφορών | 9.411 | 7.245 |
| Σοβαρές ανεπιθύμητες ενέργειες | 5.074 | 2.089 |
| Αναφορές με θανατηφόρο έκβαση | 130 | 144 |
| Αναφορές παιδιών/εφήβων 12-17 ετών | 115 | 112 |
| Περιστατικά μυοκαρδίτιδας (12-17 ετών) | 26 | 39(+6 περικαρδίτιδας) |
| Αναφορές κατά την εγκυμοσύνη (συμπεριλαμβανομένων πρόωρων τοκετών και αποβολών/διακοπών κυήσεων) | 13 | 14 |
| Περιστατικά αναφορών κατά το θηλασμό | 9 | 4 |
| Αναφορές διαταραχών έμμηνου ρύσεως | 100+ | 49 |
| Περιστατικά μυοκαρδίτιδας/περικαρδίτιδας | 243 | 218 |
| Αναφορές κολπικής μαρμαρυγής | 37 | 48 |
| Αναφορές πνευμονικών εμβολών | 82 | 82 |
| Αναφορές εμφράγματος του μυοκαρδίου | 41 | 56 |
| Αναφορές εγκεφαλικών επεισοδίων | 139 | 47 |
Να τονίσουμε εδώ ότι η διαφορά στα δεδομένα πιθανότατα οφείλεται στη καθυστέρηση της όλης διαδικασίας(Κίτρινη κάρτα ->ΕΟΦ->Eudravigilance). Η ημερομηνία στον ΕΜΑ αντιπροσωπεύει την ημέρα λήψης της εγγραφής και εισαγωγής στη βάση δεδομένων της Ευρωπαϊκής Φαρμακοεπαγρύπνησης.
Επίσης, ο ΕΟΦ ίσως να εξετάζει αρχικά και να ξεχωρίζει τις αναφορές πριν τις αποστείλει στον Ευρωπαϊκό οργανισμό. Όσες θεωρεί ότι δεν είναι άξιες επεξεργασίας, τις διαγράφει από τη λίστα των ανεπιθύμητων ενεργειών ή τις θέτει σε “ανενεργή” κατάσταση. Ο ίδιος αναφέρει ότι “..δεδομένου του μαζικού εμβολιασμού και του επακόλουθου μεγάλου όγκου αναφορών πιθανολογούμενων ανεπιθύμητων ενεργειών, η διαβίβασή τους στην ευρωπαϊκή βάση γίνεται με προτεραιοποίηση των περιστατικών ενδιαφέροντος“.
Εντύπωση προκαλεί το γεγονός ότι ο ΕΟΦ αναφέρει λιγότερους θανάτους στην ανακοίνωσή του από τους θανάτους που έχει αποστείλει στον ΕΜΑ. Από τις 130 θανατηφόρες αναφορές, για περισσότερες από τις μισές (53%) έκρινε ο ΕΟΦ ότι δεν ήταν πιθανή η συσχέτισή τους με τον εμβολιασμό (unlikely). 31 (24%) αναφορές δεν ήταν δυνατό να αξιολογηθούν από τα διαθέσιμα στοιχεία που έχουν αποσταλεί (unassessable) και 23 (18%) αναφορές δεν έχει ολοκληρωθεί η αξιολόγησή τους (conditional), διότι αναμένονται συμπληρωματικά στοιχεία που έχουν ζητηθεί (π.χ πορίσματα ιατροδικαστικών εκθέσεων και άλλες πληροφορίες). 4 αναφορές αξιολογήθηκαν ότι έχουν ισχυρή πιθανότητα συσχέτισης με τον εμβολιασμό (probable) και 3 αναφορές αξιολογήθηκαν ότι έχουν πιθανότητα συσχέτισης με τον εμβολιασμό (possible).
Ανησυχητικά είναι και τα περιστατικά εμφάνισης μυοκαρδίτιδας/περικαρδίτιδας στους νέους ηλικίας 12-17 ετών. Και εκεί παρατηρούμε μια σημαντική διαφορά στα στοιχεία της ανακοίνωσης του ΕΟΦ και στα στοιχεία του ΕΜΑ. Στα δεδομένα του Ευρωπαϊκού οργανισμού παρατηρούμε οτι υπάρχουν 12 περιστατικά μυοκαρδίτιδας χωρίς αναφορά ηλικίας τα οποία όμως σύμφωνα με το πεδίο “age group reporter” μπορούμε εύκολα να εξάγουμε το συμπέρασμα ότι πρόκειται για εφήβους και παιδιά.
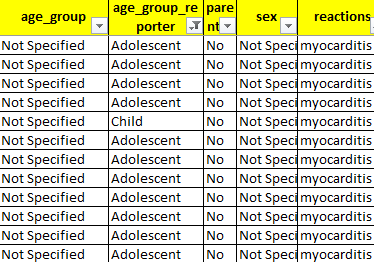
Case closed για τον ΕΟΦ: Δεν υπάρχει νεκρός ανήλικος μετά από τη χρήση του BioNTech στην Ελλάδα, καμία αναφορά σε βρέφη και παιδιά 0-11 ετών
Σύμφωνα με τα δεδομένα που μας απέστειλε ο ΕΜΑ, στην ηλικιακή ομάδα 12-17 ετών υπάρχει μία αναφορά για έναν νεκρό μετά τον εμβολιασμό με το προϊόν των BioNTech/Pfizer. Ήδη από τον Δεκέμβριο του 2021 είχαμε γράψει για το θέμα της φαρμακοεπαγρύπνησης στην Ελλάδα και τις ελλιπείς αναφορές (συγκριτικά με άλλες χώρες) καθώς και το χαμηλό αριθμό αναφορών.
Πρόκειται για την αναφορά EU-EC-10010009963 που υποβλήθηκε στον ΕΜΑ στις 15.09.2021 (αγόρι 15 ετών σύμφωνα με τον ΕΟΦ) και στην οποία υπάρχει απλώς το αποτέλεσμα: αιφνίδιος θάνατος (α/α – θανατηφόρο – οδηγεί σε θάνατο, άλλη ιατρικά σημαντική κατάσταση)
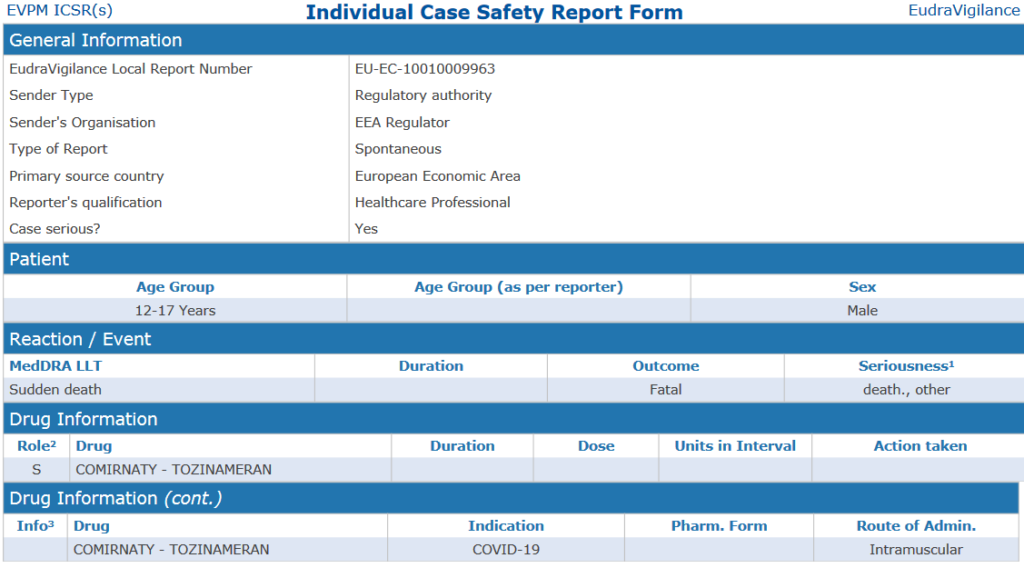
Ο ΕΟΦ αναφέρει στο έγγραφο ότι για την κατηγορία των αναφορών με θανατηφόρο έκβαση, τα δεδομένα εξετάζονται κατά προτεραιότητα απο την ΟΕ/E. ΕΦΑΡ (Εθνική Επιτροπή Φαρμακοεπαγρύπνησης). Για τη συγκεκριμένη αναφορά του 15χρονου, δεν κατέστη απο τον ΕΟΦ δυνατή η αξιολόγησή της και τέθηκε σε “κατάσταση μη αξιολογήσιμη” (unassessable).

Αυτό βέβαια που δεν αναφέρεται είναι εάν προηγήθηκε η αξιολόγηση των δεδομένων και εάν ο ΕΟΦ ζήτησε περισσότερα στοιχεία για το συγκεκριμένο σοβαρό συμβάν.
Σύμφωνα με τον Οργανισμό, η κατάσταση conditional αφορά τις αναφορές που δεν έχει ολοκληρωθεί ακόμα η αξιολόγησή τους διότι αναμένονται συμπληρωματικά στοιχεία (π.χ πορίσματα ιατροδικαστικών εκθέσεων). Το ερώτημα εδώ που προκύπτει είναι αν ο Οργανισμός έθεσε τη συγκεκριμένη αναφορά πρώτα σε κατάσταση conditional και μετά σε unassessable. Ζήτησε συμπληρωματικά στοιχεία για την συγκεκριμένη αναφορά; Και αν ναι, τι μας δείχνουν τα στοιχεία αυτά;
Επιπλέον ο ΕΟΦ δεν ασχολείται με την ηλικιακή ομάδα 0-11 ετών για την οποία υπάρχουν ήδη αρκετές αναφορές. Αρκετές από αυτές αφορούν σοβαρά περιστατικά κατά την εγκυμοσύνη (συμπεριλαμβανομένων πρόωρων τοκετών και αποβολών/διακοπών κυήσεων) για τις οποίες ο ΕΟΦ έχει λάβει 13 αναφορές. Τα δεδομένα που μας έχει αποστείλει ο ΕΜΑ αναφέρουν 14.
Για τα βρέφη και τα παιδιά ηλικίας 0-11 ετών υπάρχουν 18 αναφορές στα δεδομένα του ΕΜΑ(που δεν συμπεριλαμβάνονται στη παραπάνω κατηγορία του ΕΟΦ με τις 13 αναφορές), τις περισσότερες από τις οποίες θα μπορούσε ένας ιατρός να τις κατατάξει στην κατηγορία των αρκετά σοβαρών. Για τις συγκεκριμένες “κίτρινες κάρτες”, δεν βρήκαμε κάποια αναφορά στην ανακοίνωση του ΕΟΦ. Συγκεκριμένα:
EU-EC-10007456071: ηλικία 0-1 μήνας, συγκοπή
EU-EC-10008635874: ηλικία 0-1 μήνας, πόνος στο στήθος, ταχυκαρδία
EU-EC-10008698147: ηλικία 0-1 μήνας, συγκοπή, έμετος
EU-EC-10009104292: ηλικία 2 μηνών-2 ετών, λεμφαδενοπάθεια
EU-EC-10009478826: ηλικία 2 μηνών-2 ετών, πυρεξία
EU-EC-10009558593: ηλικία 0-1 μήνας, εμβολή , υποαισθησία
EU-EC-10010105597: ηλικία 0-1 μήνας, πόνος στην πλάτη, πόνος στο στήθος, δύσπνοια, ταχυκαρδία
EU-EC-10010308278: ηλικία 0-1 μήνας, κόπωση, διαταραχή βάδισης
EU-EC-10010375840: ηλικία 0-1 μήνας, ασθματική κρίση, διόγκωση του μαστού, λεμφαδενοπάθεια, πυρεξία
EU-EC-10010682417: ηλικία 2 μηνών-2 ετών, καρδιακή ανεπάρκεια, κατακράτηση υγρών, υπεζωκοτική συλλογή
EU-EC-10010962033: ηλικία 2 μηνών-2 ετών, υπερευαισθησία
EU-EC-10011192981: ηλικία 3-11 ετών, covid-19, φάρμακο αναποτελεσματικό, ανοσοποίηση, προϊόν που χορηγήθηκε σε ασθενή ακατάλληλης ηλικίας
EU-EC-10011231883: ηλικία 3-11 ετών, ζάλη, απώλεια συνείδησης, έμετος
EU-EC-10011253410: ηλικία 3-11 ετών, έμετος
EU-EC-10011253841: ηλικία 3-11 ετών, κνησμός, εξάνθημα
EU-EC-10011329337: ηλικία 2 μηνών-2 ετών, διάρροια
EU-EC-10011397318: ηλικία 3-11 ετών, εξάνθημα
EU-EC-10010820898: άγνωστη ηλικία(κατηγορία παιδί), μυοκαρδίτιδα, προϊόν που χορηγήθηκε σε ασθενή ακατάλληλης ηλικίας
Ενδιαφέρον παρουσιάζει και το χρονικό διάστημα μεταξύ εμβολιασμού και δηλούμενου θανάτου
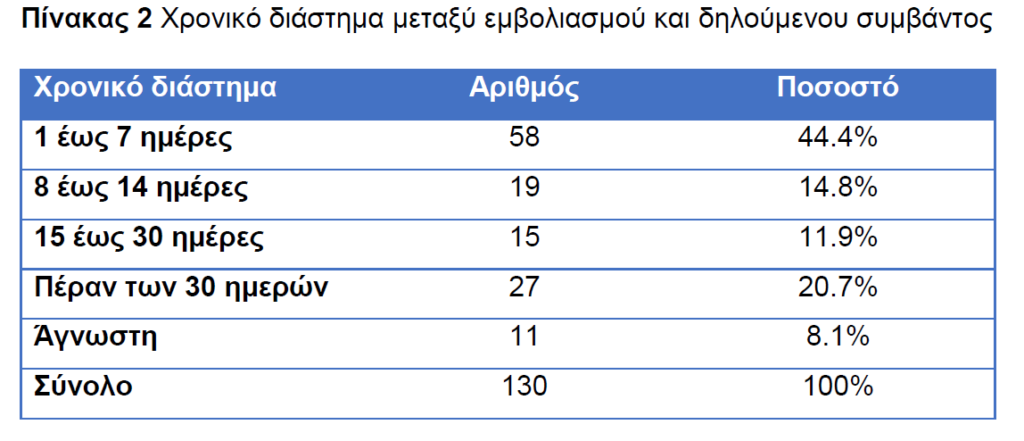
Από το παραπάνω πίνακα συμπεραίνει κανείς οτι οι περισσότερες αναφορές θανατηφόρων περιστατικών μετά τη χορήγηση των ενέσεων καταγράφηκαν την 1η εβδομάδα μετά τη χορήγηση και μετά ακολουθεί σε συχνότητα το χρονικό διάστημα δήλωσης θανάτου(ημερομηνία δήλωσης) πέραν των 30 ημερών.
Η σχέση κινδύνου-οφέλους του φαρμάκου
Ο ΕΟΦ στο έγγραφό του αναφέρει τα ακόλουθα:
Σύμφωνα με το άρθρο 4 του Κανονισμού 507/2006:
«Άδεια κυκλοφορίας υπό όρους μπορεί να χορηγηθεί όταν η επιτροπή διαπιστώνει ότι, ενώ δεν έχουν υποβληθεί εκτενή κλινικά στοιχεία σχετικά με την ασφάλεια και την αποτελεσματικότητα του φαρμάκου πληρούνται οι ακόλουθες απαιτήσεις:
• η σχέση κινδύνου-οφέλους του φαρμάκου, όπως ορίζεται στο άρθρο 1 παράγραφος 28 α της οδηγίας 2001/83/ΕΚ, είναι θετική.
• αναμένεται ότι ο αιτών θα είναι σε θέση να υποβάλει εκτενή κλινικά στοιχεία.
• καλύπτονται ανικανοποίητες ιατρικές ανάγκες.
• το όφελος για τη δημόσια υγεία από την άμεση διαθεσιμότητα στην αγορά του εν λόγω φαρμάκου είναι μεγαλύτερο από τον κίνδυνο που εμπεριέχει το γεγονός ότι απαιτούνται ακόμη συμπληρωματικά στοιχεία».
Σύμφωνα με τους ανανεωμένους υπολογισμούς των Ιωαννίδη και Axfors, το μέσο IFR (Ποσοστό θνησιμότητας λοίμωξης – Infection Fatality Rate) της Covid-19 έχει ως εξής:
| Ηλικία | Μέσο IFR | Εκτίμηση ποσοστού επιβίωσης | Εκτίμηση ποσοστού θνησιμότητας |
| 0-19 | 0.0013% | 99.9987% | 0.0013% |
| 20-29 | 0.0088% | 99.9912% | 0.0088% |
| 30-39 | 0.021% | 99.9790% | 0.021% |
| 40-49 | 0.042% | 99.9580% | 0.042% |
| 50-59 | 0.14% | 99.8600% | 0.14% |
| 60-69 | 0.65% | 99.3500% | 0.65% |
Σύμφωνα με τον ΕΟΦ, από τις αναφορές μυοκαρδίτιδας/περικαρδίτιδας, 26 αναφορές αφορούσαν σε παιδιά και εφήβους 12-17 ετών και 54 αναφορές αφορούσαν σε νέους 18-29 ετών.
Με τα διαθέσιμα στοιχεία, μπορούμε να εξάγουμε συμπεράσματα για το ποσοστό εμφάνισης διάφορων ασθενειών μετά τη χορήγηση των πειραματικών σκευασμάτων κατά της Covid-19.
| Ανεπιθύμητη ενέργεια | Ποσοστό εμφάνισης περιστατικών επί των συνολικών εμβολιασμών |
| μυοκαρδίτιδα/περικαρδίτιδα 12-17 ετών | 0,0061% |
| μυοκαρδίτιδα/περικαρδίτιδα 18-29 ετών | 0,0079% |
| σοβαρές ανεπιθύμητες ενέργειες | 0,03% |
| μη σοβαρές ανεπιθύμητες ενέργειες | 0.022% |
| περιστατικών με θρομβώσεις, εξαιρουμένων πνευμονικών εμβολών, εμφραγμάτων του μυοκαρδίου και εγκεφαλικών επεισοδίων | 0,0012% |
| ποσοστό σοβαρών αιμωδιών-δυσαισθησιών-παραισθησιών | 0,0016% |
Αν συγκρίνουμε το ποσοστό θνησιμότητας της λοίμωξης Covid-19 με τα ποσοστά σοβαρών ανεπιθύμητων ενεργειών, το ποσοστό εμφάνισης μυοκαρδίτιδας σε παιδιά και νέους κλπ, δεν μπορούμε πραγματικά να βρούμε το λόγο γιατί εμβολιάζονται κυρίως οι νέοι. Είναι η σχέση κινδύνου-οφέλους των φαρμάκων πραγματικά θετική; Από πού πηγάζει ένα τέτοιο συμπέρασμα;
Να θυμίσουμε ότι η Ελλάδα κατέχει τη τελευταία θέση στην Ευρώπη όσον αφορά το θέμα της Φαρμακοεπαγρύπνησης, όπως έχουμε αναλύσει και συμπεράνει αρκετές φορές. Σύμφωνα με υπολογισμούς, το νοσηλευτικό προσωπικό καθώς και οι συγγενείς δηλώνουν τις ανεπιθύμητες ενέργειες σε ποσοστό 4-5% στη χώρα μας.
Η μυοκαρδίτιδα αναφέρεται στην φλεγμονή του μυοκαρδίου (δηλ. του μυϊκού ιστού της καρδιάς) και την επακόλουθη νέκρωση μυοκαρδιακών κυττάρων. Οι σοβαρότερες επιπλοκές της μυοκαρδίτιδας είναι η οξεία ή/και χρόνια καρδιακή ανεπάρκεια, οι αρρυθμίες, και, σπανιότερα, ακόμη και ο αιφνίδιος καρδιακός θάνατος.
Η θνητότητα είναι μεγαλύτερη κατά τη διάρκεια της οξείας φάσης της μυοκαρδίτιδας στα παιδιά. Οι περισσότεροι ασθενείς παρουσιάζουν αποκατάσταση της καρδιακής λειτουργίας χωρίς υπολειπόμενη νόσο, ωστόσο ένα μικρό ποσοστό εμφανίζει διατατική μυοκαρδιοπάθεια. Τα ποσοστά θνησιμότητας στα παιδιά στην οξεία φάση κυμαίνεται μεταξύ 6-14%. Θάνατοι μετά την οξεία φάση είναι λιγότερο συχνοί (<5% των ασθενών). Παράγοντες που σχετίζονται με αυξημένο κίνδυνο θανάτου είναι η κεραυνοβόλος μυοκαρδίτιδα, το ελαττωμένο κλάσμα εξώθησης <30%, η ανάγκη μηχανικής υποστήριξης , η ανάγκη ενδοφλέβιας ινότροπης υποστήριξης , οι ταχυαρρυθμίες και τα αυξημένα επίπεδα νατριουρητικών πεπτιδίων. 5-20% παιδιών με οξεία μυοκαρδίτιδα μπορεί να χρειαστούν μεταμόσχευση καρδιάς.
Αν και τα περισσότερα παιδιά τελικά έχουν πλήρη ή μερική αποκατάσταση της καρδιακής τους λειτουργίας , ένα ποσοστό αναπτύσσει χρόνια διατατική μυοκαρδιοπάθεια. Η αποκατάσταση της καρδιακής λειτουργίας είναι σταδιακή σε διάρκεια μηνών έως ετών.
Η πρόγνωση της μυοκαρδίτιδας στους ενήλικες ποικίλει ανάλογα με το αίτιο, τον τύπο και τη σοβαρότητα των συμπτωμάτων. Στην πλειοψηφία των ασυμπτωματικών ασθενών η φλεγμονώδης διεργασία είναι αυτοπεριοριζόμενη. Μια μειοψηφία των αρχικά ασυμπτωματικών ασθενών αναπτύσσει καρδιακή ανεπάρκεια και σοβαρές αρρυθμίες. Σπανιότερα η μυοκαρδίτιδα σ’ αυτούς είναι θανατηφόρα.
Αντίθετα, οι περισσότεροι ασθενείς με συμπτώματα μετά από ιογενή μυοκαρδίτιδα παρουσιάζουν καρδιακή ανεπάρκεια και διατατική μυοκαρδιοπάθεια.
Σε μια μειοψηφία ασθενών με οξεία μυοκαρδίτιδα, η καρδιακή δυσλειτουργία μπορεί να παραμείνει για μήνες ή χρόνια.
Μπορεί ο ΕΜΑ ή ο ΕΟΦ να αναστείλει ή να αποσύρει τη διάθεση των συγκεκριμένων προϊόντων από την αγορά;
Η απάντηση είναι: σίγουρα ναι
Και οι λέξεις-κλειδιά είναι “σχέση κινδύνου-οφέλους”.
Με την απόφαση του Γενικού Δικαστηρίου (έκτο τμήμα) της ΕΕ της 19ης Δεκεμβρίου 2019, απαγορεύτηκε στην εταιρεία Vanda Pharmaceuticals Ltd η διάθεση του προϊόντος Fanaptum στην Ευρωπαϊκή Ένωση, το οποίο περιέχει τη δραστική ουσία ιλοπεριδόνη. Το φάρμακο Fanaptum, το οποίο ενδείκνυται για την αντιμετώπιση των συμπτωμάτων της σχιζοφρένειας σε ενήλικες, έχει προφίλ αντίστοιχο με αντιψυχωσικού φαρμάκου «δεύτερης γενιάς». Διατίθεται στην αγορά των Ηνωμένων Πολιτειών από το 2010, καθώς και του Ισραήλ και του Μεξικού από το 2012. Το δικαστήριο στην απόφασή του τονίζει τα εξής:
Λαμβάνοντας υπόψη όλα τα διαθέσιμα μη κλινικά και κλινικά δεδομένα (συμπεριλαμβανομένων της αναλυτικής μελέτης για το διάστημα QTc, του συνολικού κλινικού προγράμματος, καθώς και των περιστατικών θανάτων καρδιακής αιτιολογίας/αιφνίδιων ανεξήγητων θανάτων κατά τις κλινικές δοκιμές και κατά το μετεγκριτικό στάδιο), η ιλοπεριδόνη διαθέτει σημαντικό και αρρυθμιογόνο δυναμικό ανάλογα με την έκθεση. Κρίνεται ότι τα προτεινόμενα μέτρα ελαχιστοποίησης των κινδύνων δεν θα μετρίαζαν επαρκώς τον κίνδυνο που προσδιορίζεται εν προκειμένω. Ως εκ τούτου, η ασφάλεια της ιλοπεριδόνης δεν έχει καταδειχθεί επαρκώς.
Εξάλλου, η αποτελεσματικότητα της ιλοπεριδόνης είναι μέτρια. Επιπροσθέτως, έχει παρουσιάσει καθυστερημένη έναρξη δράσης, γεγονός που εγείρει σημαντική ανησυχία όσον αφορά τη θεραπεία της οξείας παρόξυνσης της σχιζοφρένειας. Συνεπώς, και λαμβάνοντας υπόψη τη συνολική ασφάλεια και την εικόνα αποτελεσματικότητας της ιλοπεριδόνης, δεν προσδιορίστηκε πληθυσμός ασθενών για τους οποίους κρίνεται ότι τα οφέλη της θεραπείας υπερτερούν των σημαντικότερων ανησυχιών για την ασφάλεια.
Βάσει των ανωτέρω, η σχέση κινδύνου-οφέλους της ιλοπεριδόνης κρίνεται αρνητική.
Το βασικό ζήτημα σχετικά με την ασφάλεια της ιλοπεριδόνης είναι ότι προκαλεί επιμήκυνση του
διαστήματος QTc (μέτρηση που γίνεται στο ηλεκτροκαρδιογράφημα και χρησιμοποιείται για την αξιολόγηση ορισμένων ηλεκτρικών ιδιοτήτων της καρδιάς) με αποτέλεσμα να υπάρχει κίνδυνος αρρυθμίας και αιφνίδιου θανάτου.
Σύμφωνα με το πόρισμα (στα Ελληνικά εδώ) που εξέδωσε ο Ευρωπαϊκός Οργανισμός Φαρμάκων (ΕΜΑ), στο πλαίσιο των κλινικών δοκιμών του Fanaptum σημειώθηκαν 6 περιστατικά αιφνίδιου θανάτου ή θανάτου λόγω καρδιακής ανεπιθύμητης ενέργειας. Δεδομένου ότι 4.423 ασθενείς έλαβαν ιλοπεριδόνη, το ποσοστό αυτό αντιστοιχεί στο 0,14% όλων των ασθενών που υποβλήθηκαν σε θεραπεία. Ελάχιστες λεπτομερείς πληροφορίες είναι διαθέσιμες για το μετεγκριτικό στάδιο.
Θα περιμέναμε από τον ΕΟΦ ή από τον ΕΜΑ να πραγματοποιήσει αντίστοιχες μελέτες για τα προϊόντα κατά της COVID-19 καθώς από όσο γνωρίζουμε, δεν έχει πραγματοποιηθεί ή δεν έχει ανακοινωθεί επίσημα από τους Οργανισμούς η σχέση κινδύνου-οφέλους. Μία τέτοια ανακοίνωση θα είχε σίγουρα ιδιαίτερο ενδιαφέρον ωστε να μπορέσουμε επιτέλους να εξάγουμε σαφή συμπεράσματα για την αποτελεσματικότητα και την ασφάλεια των προϊόντων αυτών.
Από τον ΕΟΦ δεν έχουμε λάβει ακόμα απαντήσεις στα ερωτήματα που έχουμε θέσει για το τόσο σοβαρό αυτό θέμα, τη γενικότερη υγεία των Ελλήνων πολιτών και τη Φαρμακοεπαγρύπνηση. Από τη συγκεκριμένη ανακοίνωση, η οποία σε σύγκριση με αντίστοιχες ανακοινώσεις άλλων εθνικών οργανισμών είναι πραγματικά θλιβερη, δεν μπορούν να διεξαχθούν πολλά σαφή συμπεράσματα. Δεν περιέχονται τα συγκεντρωτικά στοιχεία καταχωρημένα ανά ηλικιακές ομάδες, τα ποσοστά εμφάνισης των περιστατικών ανά ομάδες λείπουν επίσης. Θα περιμέναμε από τον ΕΟΦ να δημοσιεύσει όλες τις αναφορές που έχει λάβει και να αφήσει ανεξάρτητους ειδικούς, ανθρώπους που ασχολούνται με τη στατιστική και ιατρικό προσωπικό να εξάγουν τα δικά τους συμπεράσματα.
Το περιεχόμενο και ο τρόπος που έχει συγγραφεί η συγκεκριμένη ανακοίνωση δείχνει τον τρόπο που ο ΕΟΦ και γενικά το Ελληνικό κράτος φαίνεται να χειρίζεται την κατάσταση. Απόλυτη αδιαφάνεια.
Follow us: